¿Vas a aplicar a alguna carrera del área de Ingenierías y ciencias físico matemáticas en el IPN? Hemos desarrollado este examen simulador de química para que practiques antes de tu examen de admisión al IPN.

Acompáñanos a descifrar los secretos de cada uno de los 15 reactivos que te prepararán para tu examen.
Recuerda los puntos clave del examen al IPN:
- Carreras ofertadas en IPN: 70+
- Porcentaje de aceptación: 20%
- Preguntas en el examen de admisión: 140 preguntas
- Nuevos temas: Historia e inglés (reading comprehension)
- Tipo: selección múltiple
Temario de Química
Los temas de química son los mismos para las ramas de Ciencias médico-biológicas (CMB) e Ingeniería y Ciencias físico-matemáticas (IyCFM).
| Tema | Ramas |
|---|---|
| Materia y energía | IyCFM, CMB, CSyA |
| Estructura atómica | IyCFM, CMB, CSyA |
| Elementos de la tabla periódica | IyCFM, CMB, CSyA |
| Enlace químico | IyCFM, CMB, CSyA |
| Nomenclatura química inorgánica | IyCFM, CMB, CSyA |
| Reacciones químicas inorgánicas | IyCFM, CMB, CSyA |
| Reacciones químicas | IyCFM, CMB, CSyA |
| Estequiometría | IyCFM, CMB, CSyA |
| Estructura y nomenclatura de compuestos orgánicos | IyCFM, CMB, CSyA |
| Reacciones químicas de compuestos orgánicos | IyCFM, CMB, CSyA |
| Estado gaseoso | IyCFM, CMB, CSyA |
| Disoluciones | IyCFM, CMB |
| Electroquímica | IyCFM, CMB |
| Termodinámica | IyCFM, CMB |
| Velocidad de reacción y equilibrio químico | IyCFM, CMB |
| Ácidos bases | IyCFM, CMB, CSyA |
Adquiere destrezas para responder correctamente en el examen de admisión. Recuerda que cuentas con nuestra asesoría educativa total en los cursos de preparación que ponemos a tu disposición.
¿Cómo resolver el simulacro?
Estos problemas han sido diseñados para que puedas practicar los temas del examen real y mejorar el tiempo que tardas en resolverlos.
Incluye exámenes simulacro en tu rutina de estudio, de esa forma pondrás a prueba tus conocimientos en condiciones similares a la prueba real.
Las siguientes son sugerencias para tener en cuenta mientras estudias con este simulacro.
- Resuelve todos los reactivos por tu cuenta antes de mirar las respuestas.
- Establece un lapso de tiempo para cada reactivo.
- Asegúrate de tener unos minutos de sobra para comprobar tus respuestas.
- Si un ejercicio parece complejo, ve al siguiente y vuelve a él de último.
- Los reactivos de química pueden parecer complejos, pero la práctica constante mejora tu desempeño. El ensayo y error te prepara para afrontar los ejercicios más complicados.
- Organiza tu tiempo en un horario de estudio diario, así sea una hora, no dejes de practicar ni un día.
Un tip especial para la resolución de reactivos en la prueba del IPN es que son preguntas específicas, es decir, en lugar de presentar enunciados generales, las preguntas son muy puntuales.
Por ejemplo, pueden venir reactivos que ejemplifiquen situaciones experimentales y tú debes elegir la opción correcta basándote en la lógica que supone el tema estudiado.
Reactivo 1
El elemento _______ no se encuentra libre en la naturaleza, sino formando sales, principalmente, por ejemplo, la sal de mesa.
- Potasio.
- Sodio.
- Litio.
- Magnesio.
Solución:
El elemento sodio no se encuentra libre en la naturaleza, sino formando sales principalmente, por ejemplo, la sal de mesa (NaCl).
Respuesta correcta opción B.
Lista completa de carreras ofertadas en el IPN
Reactivo 2
La ______________ se encarga de encontrar, analizar y explicar la naturaleza de los radioisótopos, los efectos de la radiación sobre la materia y la síntesis de elementos o compuestos radiactivos.
- Inmunoquímica.
- Cristalografía.
- Radioquímica.
- Química cuántica.
Solución:
La radioquímica se encarga de encontrar, analizar y explicar la naturaleza de los radioisótopos, los efectos de la radiación sobre la materia y la síntesis de elementos o compuestos radiactivos. También, las técnicas radioquímicas se emplean en la determinación del producto de solubilidad de diversos compuestos.
Respuesta correcta opción C.
Reactivo 3
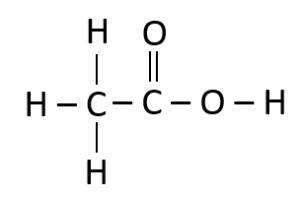
De los siguientes compuestos químicos seleccione el que está escrito en su fórmula semidesarrollada.
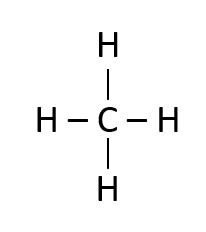
- C{H}_{3}-C{H}_{2}-C\equiv C-C{H}_{2}OH
- {C}_{6}{H}_{6}
Solución:
Las fórmulas semidesarrolladas no muestran los enlaces con el hidrógeno, señalan los enlaces covalentes entre C – C y otros elementos diferentes al hidrógeno.
La única fórmula química que reúne los requisitos es C{H}_{3}-C{H}_{2}-C\equiv C-C{H}_{2}OH .
Respuesta correcta opción B.
Conoce los aciertos que necesitas por carrera
Reactivo 4
Seleccione la reacción química en donde se indique la precipitación del cloruro de calcio
- Ca{\left(OH\right)}_{2 \left(s\right)}+2HC{l}_{\left(ac\right)}\to CaC{l}_{2}\uparrow +{H}_{2}{O}_{\left(l\right)}
- CaCO \to CaO+C{O}_{2}\uparrow
- Ca{\left(OH\right)}_{2 \left(s\right)}+2HC{l}_{\left(ac\right)}\to CaC{l}_{2}\downarrow +{H}_{2}{O}_{\left(l\right)}
- CaCO \to CaO\downarrow +C{O}_{2}\uparrow
Solución:
En las ecuaciones químicas, los elementos que precipitan se indican con el siguiente símbolo (\downarrow ) o (s).
La reacción Ca{\left(OH\right)}_{2 \left(s\right)}+2HC{l}_{\left(ac\right)}\to CaC{l}_{2}\downarrow +{H}_{2}{O}_{\left(l\right)} señala la precipitación del cloruro de calcio, como puedes ver el CaC{l}_{2} tiene el símbolo que indica su precipitación.
Respuesta correcta opción C.
Conoce todo sobre el siguiente proceso de selección: Convocatoria IPN 2023.
Reactivo 5
Calcule el peso molecular (g/mol) del hidróxido de magnesio \left[Mg{\left(OH\right)}_{2}\right] . Masas atómicas: Mg = 24; H = 1; O = 16
- 41 g/mol
- 58 g/mol
- 64 g/mol
- 23 g/mol
Solución:
Consideramos las masas atómicas de cada uno de los elementos, que nos brinda el enunciado y las multiplicamos por la cantidad de átomos de cada elemento presente en el hidróxido de magnesio
- 1 átomo de magnesio (el producto de la multiplicación es el mismo valor que su masa atómica).
- 2 átomos de oxígeno multiplicados por la masa atómica del elemento
- 2 átomos de hidrógeno multiplicados por la masa atómica del elemento
PM del hidróxido de magnesio:
PM Mg{\left(OH\right)}_{2}=\left(24+32+2\right) g/mol=58g/mol
PM Mg{\left(OH\right)}_{2}=58 g/mol
Respuesta correcta opción B.
Reactivo 6
La masa pura de un reactivo contenido en 100 g del mismo se representa mediante:
- %pureza.
- Fracción de pureza.
- %único.
- Fracción limpia.
Solución:
En la práctica química, y de otras ciencias, es importante conocer el % pureza de los reactivos con los que se llevan a cabo las reacciones químicas, ya que garantiza la exactitud durante cualquier análisis. En los cálculos estequiométricos, al igual que el ajuste de la ecuación, saber la pureza de las sustancias es esencial para llevar a cabo cualquier proceso cuantitativo.
El % pureza indica la masa pura de un reactivo contenido en 100 g del mismo.
Respuesta correcta opción A.
Reactivo 7
Indique en el recuadro la función faltante
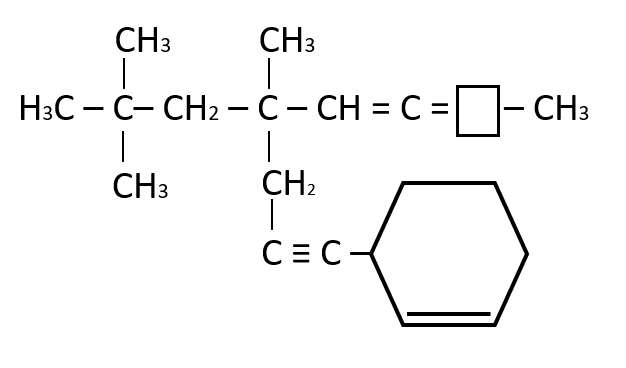
- C
- CH
- C{H}_{2}
- C{H}_{3}
Solución:
El carbono como elemento del grupo IVA, puede compartir cuatro electrones de valencia y formar cuatro enlaces covalentes fuertes; además, pueden unirse entre ellos y formar cadenas largas y anillos. En el compuesto que brinda el enunciado la función faltante es un CH, así el carbono completa los cuatro enlaces que puede establecer con otros elementos.
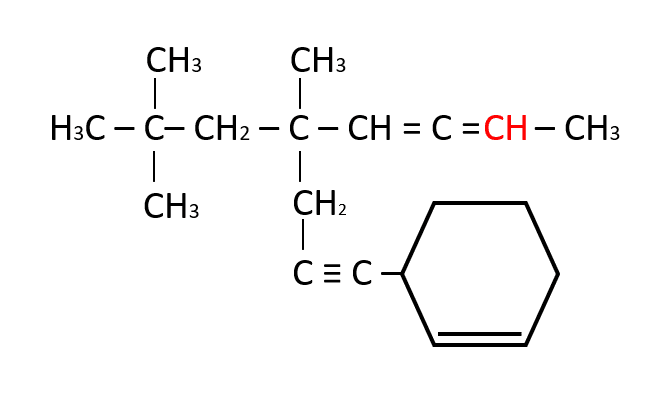
Respuesta correcta opción B.
Reactivo 8
Identificar el tipo de función química del siguiente compuesto orgánico
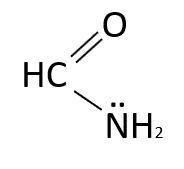
- Amina
- Éster
- Cloruro de acilo
- Amida
Solución:
Las amidas con un grupo –\ddot{N}{H}_{2} no sustituido se derivan del ácido carboxílico. Una de las reacciones que originan amidas es la conversión de los cloruros de ácido con amoniaco, al mezclarlos reaccionan con rapidez y producen amidas. El compuesto del enunciado es una metanamida, también conocida como formamida.
Respuesta correcta opción D.
Reactivo 9
¿Qué tipo de ruptura representa el siguiente esquema?
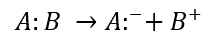
- Ruptura homolítica.
- Ruptura heterolítica.
- Ruptura en radicales.
- Ruptura equivalente.
Solución:
La ruptura heterolítica de un enlace ocurre en las reacciones polares cuando un fragmento sale con ambos electrones de enlace como lo representa el esquema del enunciado.
Uno de los dos átomos, durante la disociación, se queda con los dos electrones.
Respuesta correcta opción B.
Reactivo 10
Identificar el tipo de reacción generada en la siguiente ecuación química:
{H}_{2}C=C{H}_{2}+HBr \to {H}_{3}C-C{H}_{2}Br
- Combustión.
- Adición de radicales libres.
- Polarización.
- Adición electrofílica.
Solución:
El H del HBr es electrofílico, por lo que en primera instancia reacciona con el alqueno para formar un carbocatión. Luego de ello, el ion bromuro reacciona rápidamente con el carbocatión generado y forma un producto estable. De esta manera, se han adicionado los elementos H y Br a los extremos de la molécula y ha desaparecido el doble enlace. A este proceso se le conoce como adición electrofílica, si analizas con detalle verás que la reacción inicia por el H electrófilo.
Respuesta correcta opción D.
Reactivo 11
Identificar el nombre del producto principal formado en la siguiente reacción:
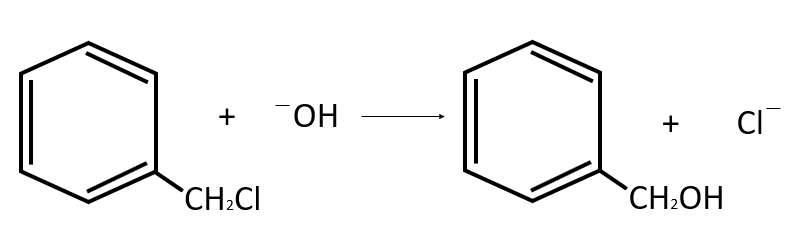
- Alcohol bencílico.
- Butanol
- Hexanol
- Benzoato de cloro.
Solución:
El producto principal de la reacción es el alcohol bencílico, representado por la estructura:
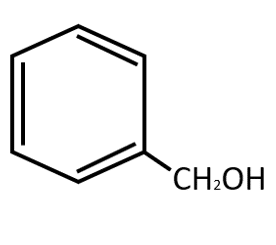
Respuesta correcta opción A.
Reactivo 12
Seleccione el tipo de reacción que se lleva a cabo:
C{H}_{3}-C{H}_{2}-C{H}_{2}-Br+N{H}_{3} \to C{H}_{3}-C{H}_{2}-C{H}_{2}-N{H}_{2}+N{H}_{4}Br
- Síntesis de Williamson.
- Síntesis de una amina.
- Síntesis de una amida.
- Degradación de una amida.
Solución:
Conocer todas las reacciones orgánicas es una tarea difícil, pero responder este estilo de reactivos suele ser más sencillo de lo que parece cuando se analizan los productos de la reacción, por ejemplo, el compuesto C{H}_{3}-C{H}_{2}-C{H}_{2}-N{H}_{2} es una amina, por lo que podemos deducir que la reacción se enfoca en la síntesis de una amina.
Teóricamente, en la síntesis de las aminas se utiliza el amoniaco que por lo general produce una amina primaria, como lo demuestra el compuesto formado.
Respuesta correcta opción B.
Reactivo 13
El trabajo generado por un sistema termodinámico expuesto a un proceso isocórico es ______.
- Cero.
- Constante.
- Infinito.
- No realizable.
Solución:
El trabajo generado por un sistema termodinámico expuesto a un proceso isocórico es igual a cero. Debido a que en un proceso isocórico (a volumen constante) no ocurre desplazamiento de frontera, que visto desde la definición operacional de trabajo, al ser nulo el desplazamiento, es nulo también el trabajo, el sistema no interactúa con su exterior.
Respuesta correcta opción A.
Reactivo 14
Determina el número de equivalentes de 40 gramos de Ca{\left(OH\right)}_{2} considerando que el peso molecular del hidróxido de calcio es igual a 74 g/mol
- 1.73 Eq
- 0.13 Eq
- 1.08 Eq
- 1.18 Eq
Solución:
Para conocer el número de equivalentes del hidróxido de calcio primero calculamos el peso equivalente:
Peq=\frac{PM}{\#OH}
Peq=\frac{74 g/mol}{2 eq/mol}=37 g/eq
Luego para conocer los equivalentes del soluto, dividimos la masa entre el peso equivalente:
Eq del soluto= \frac{Masa de soluto }{Peq}
Eq= \frac{40g}{37 g/eq}=1.08 Eq
Eq de Ca{\left(OH\right)}_{2}=1.08
Respuesta correcta opción C.
Reactivo 15
La cantidad de electricidad que transporta un mol de electrones es igual a __________.
- 96,500 C.
- 10,000 C.
- 12,000 C.
- 98,000 C.
Solución:
La cantidad de electricidad que transporta un mol de electrones es igual a 96,500 C.
Respuesta correcta opción A.


