Te presentamos la cuarta entrega del examen simulador de química, una herramienta esencial para los que buscan un lugar en las carreras del área de Ingeniería y Ciencias Físico Matemáticas del IPN. Este desafío consta de 15 reactivos que pondrán a prueba tu preparación para el examen de ingreso.

¡Felicidades! Ya casi terminas la serie de exámenes simulacro de química para el área de IyCFM. Sigue aprendiendo con nuestra ayuda hasta llegar a la meta.
¿Cuál es el temario de Química?
Uno de los puntos esenciales en la preparación para una prueba de ingreso a la universidad es conocer los temas a estudiar en los módulos específicos.
Para química, el temario es igual para las carreras de ciencias médico-biológicas (CMB) e ingeniería y ciencias físico-matemáticas (IyCFM) y se resumen en la siguiente tabla:
| Tema | Ramas |
|---|---|
| Materia y energía | IyCFM, CMB, CSyA |
| Estructura atómica | IyCFM, CMB, CSyA |
| Elementos de la tabla periódica | IyCFM, CMB, CSyA |
| Enlace químico | IyCFM, CMB, CSyA |
| Nomenclatura química inorgánica | IyCFM, CMB, CSyA |
| Reacciones químicas inorgánicas | IyCFM, CMB, CSyA |
| Reacciones químicas | IyCFM, CMB, CSyA |
| Estequiometría | IyCFM, CMB, CSyA |
| Estructura y nomenclatura de compuestos orgánicos | IyCFM, CMB, CSyA |
| Reacciones químicas de compuestos orgánicos | IyCFM, CMB, CSyA |
| Estado gaseoso | IyCFM, CMB, CSyA |
| Disoluciones | IyCFM, CMB |
| Electroquímica | IyCFM, CMB |
| Termodinámica | IyCFM, CMB |
| Velocidad de reacción y equilibrio químico | IyCFM, CMB |
| Ácidos bases | IyCFM, CMB, CSyA |
Si te preguntas ¿Cuánto tiempo tengo para responder el examen? Contarás con 180 minutos para la resolución del examen de admisión. Sin embargo, por acá te dejamos una lista resumen que concentra los puntos más importantes del examen de ingreso al IPN:
- Carreras ofertadas en IPN: 70+
- Porcentaje de aceptación: 20%
- Preguntas en el examen de admisión: 140 preguntas
- Nuevos temas: Historia e Inglés (reading comprehension)
- Tipo: selección múltiple
¿Es díficil ser aceptado en el IPN?
La respuesta es: ¡Sí! Como habrás leído en la sección anterior, la tasa de aceptación es de apenas el 20% un valor muy bajo para la cantidad de aspirantes que aplican el examen anualmente.
¿Qué puedes hacer para ser admitido? Prepararte y aprovechar cada una de las herramientas que ponemos a tu disposición. No se trata solo de pasar horas y horas leyendo un libro, es importante que complementes con exámenes simulacro para agilizar tus tiempos de respuesta reforzando los conocimientos adquiridos.
Consulta los aciertos que necesitas por carrera.
Reactivo 1
El elemento __________ se encuentra libre y combinado en la naturaleza y se utiliza para la fabricación de insecticidas, fertilizantes, esmaltes, ácidos. En la medicina se utiliza en jabones y cremas para la piel.
- Zinc.
- Selenio.
- Azufre.
- Bromo
Solución:
El azufre es un elemento de gran aplicabilidad en la industria, se encuentra libre y combinado en la naturaleza. Es utilizado para la fabricación de insecticidas, fertilizantes, esmaltes, ácidos. En la medicina se utiliza para fabricar jabones y cremas para la piel, forma parte de algunos aminoácidos como la cisteína y metionina.
Respuesta correcta opción C.
Reactivo 2
Nombre del científico que es considerado el padre de la química moderna:
- Charles Darwin.
- John Dalton.
- Antoine Lavoisier.
- Louis Joseph Gay-Lussac.
Solución:
Antoine Lavoisier (1743-1794) aportó la rigurosidad del método cuantitativo, propuso la Ley de la Conservación de la Materia y destruyó la teoría del flogisto, la cual aseguraba que toda sustancia que sufra combustión contenía flogisto. Se considera el padre de la química moderna.
Respuesta correcta opción C.
Conoce todo sobre el siguiente proceso de selección: Convocatoria IPN.
Reactivo 3
Relacionar el tipo de fórmula con su descripción correspondiente:

- 1B, 2C, 3D, 4A
- 1A, 2D, 3B. 4C
- 1D, 2A, 3C, 4D
- 1D, 2C, 3A, 4B
Solución:
Las relaciones son las siguientes:
- Fórmula Condensada: Indica de forma resumida la cantidad de átomos presentes en el compuesto. Ejemplo: {C}_{6}{H}_{6} . Relación 1B.
- Fórmula desarrollada: Indica los enlaces presentes en la cadena y la distribución de los átomos presentes. Brinda información detallada del compuesto. Relación 2C.
- Fórmula semidesarrollada: Informa sobre cómo está enlazada la cadena carbonada y cuáles y cuántos átomos se unen al átomo de carbono. Ejemplo: C{H}_{3}-C{H}_{2}-CH=CH-C{H}_{3} . Relación 3D,
- Fórmula taquigráfica o esqueletal: Se utiliza para representar las estructuras más complejas de los compuestos orgánicos mediante líneas, en ella no se escriben los átomos de hidrógeno ni de carbono. Relación 4A.
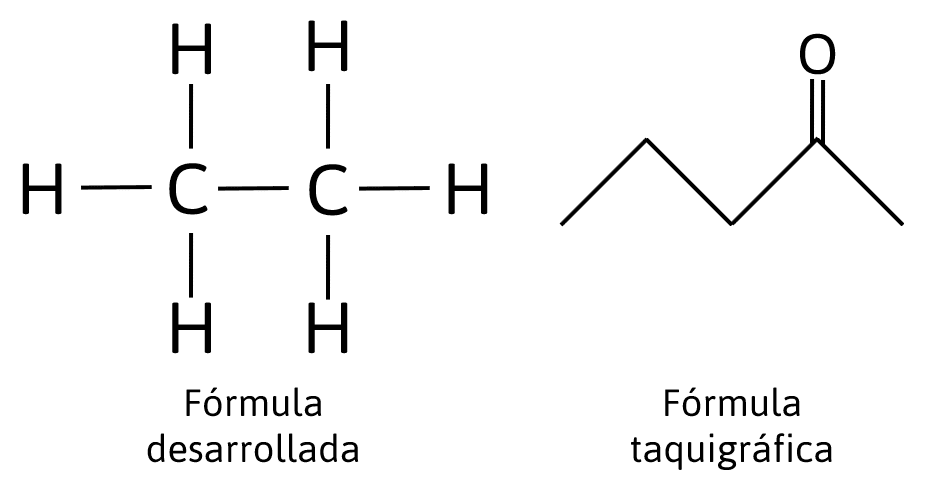
Respuesta correcta opción A.
Reactivo 4
Seleccione la ecuación química en donde visualiza la precipitación del sulfato de bario
- 2Ba\left(N{O}_{3}\right)\stackrel{∆}{\to } 2BaO+4N{O}_{2}+{O}_{2}
- BaB{r}_{\left(ac\right)}+{K}_{2}S{O}_{4 \left(ac\right)}\to 2KB{r}_{\left(ac\right)}+BaS{O}_{4}\downarrow
- 2Ba\left(N{O}_{3}\right)\stackrel{∆}{\to } 2BaO+4N{O}_{2}+{O}_{2}\uparrow
- BaB{r}_{\left(ac\right)}+{K}_{2}S{O}_{4 \left(ac\right)}\to 2KB{r}_{\left(ac\right)}+BaS{O}_{4}\uparrow
Solución:
La precipitación del sulfato de bario se observa en la reacción química:
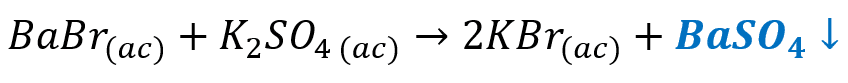
Recuerda que la precipitación de un compuesto se indica con una flecha apuntando hacia abajo o con una (s).
Respuesta correcta opción B.
Reactivo 5
Calcular el peso molecular (g/mol) del sulfato de zinc ( ZnS{O}_{4}) . Masas atómicas (g/mol): Zn = 65; S = 32; O = 16.
- 97 g/mol
- 113 g/mol
- 194 g/mol
- 161 g/mol
Solución:
Para calcular el peso molecular del sulfato de zinc, primero debemos multiplicar la masa atómica de cada elemento por la cantidad de átomos presentes en el compuesto:
- Zn: 65 g/mol\times 1=65 g/mol
- S: 32 g/mol\times 1=32 g/mol
- O: 16 g/mol\times 4=64 g/mol
Luego de ello se suman los resultados y se obtiene el peso molecular o la masa molar del compuesto:
PM ZnS{O}_{4}=\left(65+32+64\right)g/mol=161 g/mol
PM ZnS{O}_{4}=161 g/mol
Respuesta correcta opción D.
Reactivo 6
Calcular la masa en kg del cloruro de plata producido al utilizar 50 kg de nitrato de plata con un 80% de pureza, de acuerdo con la siguiente ecuación:
AgN{O}_{3}+NaCl \to AgCl+NaN{O}_{3}
PM g/mol: AgN{O}_{3}=169.8;AgCl=143.3
- 32 Kg
- 37.53 Kg
- 33.76 Kg
- 12.5 Kg
Solución:
Para conocer la masa de cloruro de plata formada, primero debemos calcular la masa pura de nitrato de plata:
Si en 100 Kg de AgN{O}_{3} hay 80 Kg puros. En 50 Kg de nitrato de plata ¿Cuántos Kg puros hay?
50 Kg impuros AgN{O}_{3}\times \frac{80 Kg puros AgN{O}_{3}}{100 Kg impuros AgN{O}_{3}}=40 Kg puros AgN{O}_{3}
Masa de AgCl a partir de 40 Kg puros de AgN{O}_{3} .
Teniendo en cuenta los pesos moleculares de las sustancias, según la reacción:
AgN{O}_{3}+NaCl \to AgCl+NaN{O}_{3}
Sabemos que 169.8 g de nitrato de plata producen 143.3 g de cloruro de plata ¿Cuántos gramos de cloruro de plata se producirán con 40 Kg de nitrato de plata?
Para conocer la masa en Kg, transformamos g\to Kg
- 8 g de AgN{O}_{3}=0.1698 Kg AgN{O}_{3}
- 3 g de AgCl = 0.1433 Kg de AgCl
La relación matemática es:
40 Kg AgN{O}_{3}\times \frac{0.1433 Kg AgCl}{0.1698 Kg\mathrm{ }AgN{O}_{3}}=33.76 Kg AgCl
Se producen 33.76 Kg de AgCl al utilizar 50 Kg de AgN{O}_{3} con un 80% de pureza.
Respuesta correcta opción C.
Puedes consultar la lista de carreras ofertadas por el IPN aquí.
Reactivo 7
Identificar la estructura faltante en el recuadro
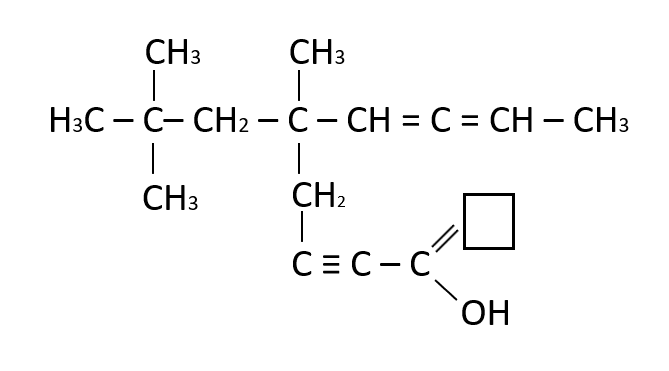
- C
- CH
- O
- C{H}_{2}
Solución:
La estructura que falta en el recuadro es un O, ya que la estructura completa (señalada en el recuadro azul) corresponde a un ácido carboxílico.
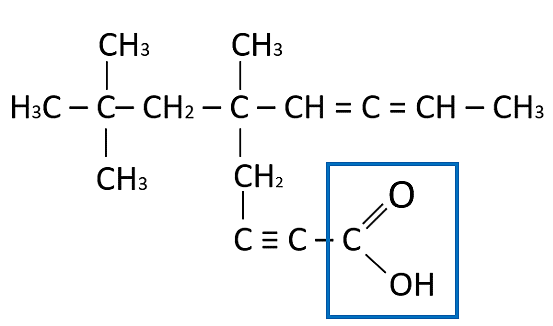
Respuesta correcta opción C.
Reactivo 8
El butirato de etilo es un compuesto orgánico cuya función química es un:
- Éter
- Éster
- Amida
- Tiol
Solución:
Los ésteres se relacionan muy de cerca con los ácidos carboxílicos. Son compuestos en los que un grupo acilo está unido a un átomo o a un sustituyente electronegativo que puede actuar como un grupo saliente las reacciones de sustitución en los compuestos orgánicos.
Se nombran primero identificando el ácido carboxílico y reemplazando la terminación -ico por -ato y suprimiendo la palabra ácido y luego el nombre del grupo alquilo unido al oxígeno.
Por ejemplo, el butirato de etilo:

Respuesta correcta opción B.
Reactivo 9
Una separación ___________ forma dos iones, mientras que una ruptura _________ produce dos radicales.
- Heterolítica – homolítica.
- Iónica – heterolítica.
- Radical – iónica.
- Homolítica – heterolítica.
Solución:
Una separación heterolítica forma dos iones, mientras que una ruptura homolítica produce dos radicales.
Respuesta correcta opción A.
Reactivo 10
Identifique la reacción que se lleva a cabo a continuación
{H}_{2}C=CH-C{H}_{2}Cl+NaI \to {H}_{2}C=CH-C{H}_{2}I+NaCl
- Síntesis de haluros.
- Síntesis de un alcano.
- Combustión.
- Intercambio de haluro.
Solución:
Una vez más el enunciado requiere la observación metódica para determinar que sucede en la reacción química. Las reacciones orgánicas son muy variadas y complejas, pero que se pueden resolver analizando someramente la ecuación química.
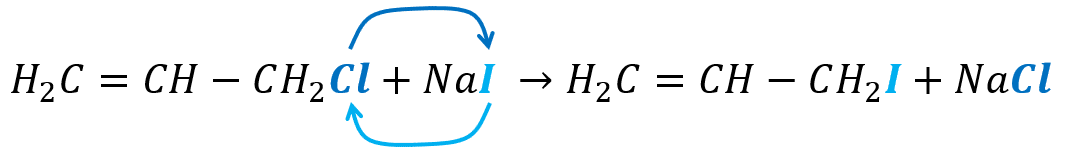
Ocurre un intercambio de haluro, simplemente el yodo (I) cambia de lugar con el cloro (Cl), mientras todo lo demás permanece inalterado.
Respuesta correcta opción D.
Reactivo 11
Diga el nombre del compuesto principal generado en la siguiente reacción química:
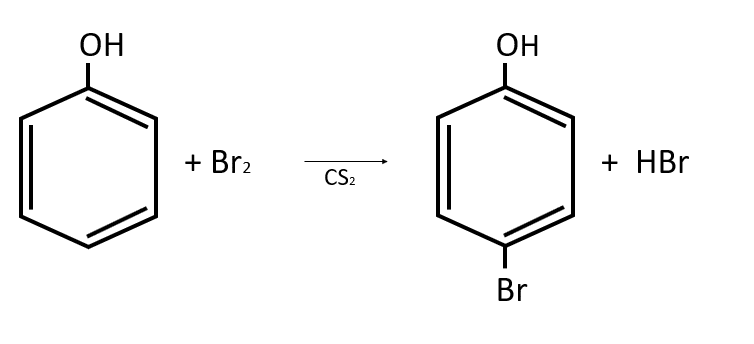
- O-bromobenceno
- p-bromofenol
- m-bromobenceno
- Bromuro de benceno
Solución:
Se toma como compuesto principal al producto con el anillo bencénico, que corresponde a una sustancia fenólica por la presencia del grupo OH. El anillo también tiene unido un halógeno (Br) en posición para (p), por lo que la nomenclatura correcta para el compuesto es p-bromofenol
Respuesta correcta opción B.
Reactivo 12
Identificar la reacción de la siguiente ecuación:
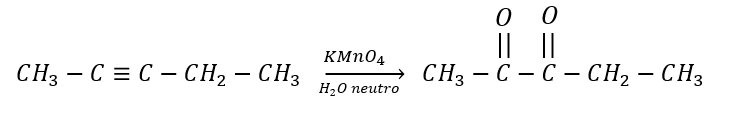
- Oxidación de un alcano.
- Sustitución de un alquino.
- Oxidación de un alquino.
- Reducción de un alcano.
Solución:
Cuando un alquino es tratado con permanganato de potasio en solución acuosa, se genera un proceso de hidroxilación de dos enlaces pi del alquino, en el que luego se pierden las moléculas de agua para formar una dicetona por la oxidación del alquino.
Para identificar la reacción en futuros enunciados, ten en cuenta que la presencia de permanganato de potasio y agua en condiciones de pH medianamente neutras permiten la oxidación de los alquinos por la modificación de sus enlaces pi, generando una dicetona.
Respuesta correcta opción C.
Reactivo 13
Mencione la ley por la que se rige el proceso isobárico de un sistema.
- Ley de Boyle.
- Ley de Gay-Lussac.
- Ley de Dalton.
- Ley de Charles.
Solución:
Los procesos isobáricos de un sistema ocurren a presión constante como los dice la ley de Charles “el volumen de una cantidad fija de gas que se mantiene a presión constante es directamente proporcional a la temperatura absoluta del gas”.
Respuesta correcta opción D.
Reactivo 14
Calcular la normalidad de una solución formada por 20 g de {H}_{2}C{O}_{3} para preparar 1.5 litros de solución.
Peso molecular del {H}_{2}C{O}_{3}=62 g/mol
- 0.427 N
- 0.004 N
- 0.444 N
- 0.043 N
Solución:
Para calcular la normalidad del ácido carbónico, iniciamos calculando el peso equivalente, el cual se obtiene al dividir su peso molecular entre la cantidad de hidrógenos presentes en el compuesto:
Peq=\frac{PM}{\# {H}^{+}}
Sustituimos los valores:
Peq= \frac{62 g/mol}{2 eq/mol}=31 g/eq
Una vez obtenido el peso equivalente se procede a calcular los equivalentes de soluto al dividir los gramos de soluto entre su peso equivalente:
Eq del soluto= \frac{Masa de soluto }{Peq}
Sustituimos los valores:
Eq de soluto= \frac{20 g HC{O}_{3}}{31 g/eq}=0.64 Eq
Una vez hallados los equivalentes y sabiendo que el volumen de la solución es un 1.5 L, sustituimos los valores en la fórmula general:
N=\frac{Eq de soluto}{L de solución}
N=\frac{0.64 Eq}{1.5 L sol}=0.427
N=1.7
La concentración de la solución es de 0.427 N
Respuesta correcta opción A.
Reactivo 15
El estado de oxidación de un átomo en una combinación química es la _______________ o la valencia con la que se encuentra.
- Reducción.
- Resistencia.
- Carga eléctrica.
- Conductividad.
Solución:
El estado de oxidación de un átomo en una combinación química es la carga eléctrica o la valencia con la que se encuentra.
Respuesta correcta opción C.


