Con este post iniciamos la solución de los 15 reactivos de la primera versión del examen simulador de química para el área de Ingeniería y Ciencias Físico Matemáticas del Instituto Politécnico Nacional.

No es un secreto que el examen de admisión al Instituto Politécnico Nacional es uno de los más complejos. Según las estadísticas anuales, solo el 20% de los aspirantes resulta seleccionado en el IPN. Por ello es importante que conozcas cada detalle de la prueba.
Estructura del Examen IPN
El examen de ingreso al Politécnico Nacional consta de dos grandes módulos: conocimientos generales y conocimientos experimentales. La dificultad de los módulos no es igual para todas las carreras, ya que varía según la rama, las cuales son:
- IyCFM: Ingeniería y ciencias físico matemáticas
- CMD: Ciencias médico biológicas
- CSyA: Ciencias sociales y administrativas
Por ejemplo, en el área de IyCFM la unidad más compleja es la de física. En la siguiente tabla resumen puedes conocer la cantidad de reactivos según la materia:
| Materia | IyCFM |
|---|---|
| Matemáticas | 37 |
| Competencia escrita | 20 |
| Competencia lectora | 20 |
| Reading comprehension | 10 |
| Historia | 10 |
| Biología | 9 |
| Química | 17 |
| Física | 17 |
Los cambios más resaltantes en la prueba de admisión al Instituto Politécnico Nacional son los siguientes:
- El examen evaluará la materia de inglés, específicamente en el tema de Reading comprehension.
- Las materias de competencia escrita y competencia lectora, sustituyeron a producción escrita y comprensión de textos.
- Cada área asigna la cantidad de reactivos por materia (como te mencionamos con anterioridad).
- Se agregó la materia de historia de México a las tres áreas de estudio.
- El examen para todas las carreras tendrá 140 reactivos (anteriormente eran 130).
Temario de Química
Los temas de quimica para el área de Ingeniería y Ciencias físico-matemáticas (IyCFM) son los siguientes:
- Química I
- Materia
- Estructura atómica
- Tabla periódica
- Enlace químico
- Nomenclatura química orgánica
- Reacciones químicas orgánicas
- Química II
- Balanceo de ecuaciones químicas
- Estequiometría
- Estructura de compuestos orgánicos
- Nomenclatura y aplicación (Reglas de nomenclatura IUPAC para compuestos orgánicos)
- Química III
- Reacciones químicas de compuestos orgánicos
- Estado gaseoso
- Disoluciones
- Electroquímica
- Química IV
- Termoquímica
- Velocidad de reacción y equilibrio químico
- Ácidos y bases
- Tecnología química
El miedo es el principal enemigo del éxito, por ello te recomendamos que estudies de forma optimizada los puntos que vienen en el temario.
También cuentas con nuestra asesoría total en los cursos de preparación que ponemos a tu disposición.
¿Cómo resolver el simulacro?
Incluye exámenes simulacro en tu rutina de estudio, de esa forma pondrás a prueba tus conocimientos en condiciones similares a la prueba real.
Los enunciados han sido diseñados para que puedas practicar los temas del examen, mejorar el tiempo que tardas en resolverlos y alcanzar los aciertos que necesitas por carrera.
Tips para resolver el simulacro:
- Responde todos los reactivos por tu cuenta antes de comprobar las respuestas.
- Establece un lapso de tiempo para cada reactivo.
- Asegúrate de tener unos minutos de sobra para comprobar tus respuestas.
- Si un ejercicio parece complejo, ve al siguiente y vuelve a él de último.
- Los reactivos de química pueden parecer complejos, pero la práctica hace al maestro.
Reactivo 1
Los ______________ se usan como trazadores de proceso químicos y biológicos mediante el seguimiento de las radiaciones que emiten. Son ampliamente utilizados en medicina, por ejemplo, el tecnecio-99 se usa para obtener imágenes de órganos.
- Isótopos.
- Radioisótopos.
- Marcadores tumorales.
- Iones cargados.
Solución:
Los radioisótopos se usan como trazadores de proceso químicos y biológicos mediante el seguimiento de las radiaciones que emiten. Son ampliamente utilizados en medicina, por ejemplo, el tecnecio-99 se usa para obtener imágenes de órganos. Es una herramienta diagnostica para el cáncer, enfermedades del sistema circulatorio y patologías de curso crónico.
Respuesta correcta opción B.
Reactivo 2
Rama de la química que estudia los compuestos derivados del carbono.
- Química analítica.
- Química inorgánica.
- Química orgánica.
- Química descriptiva.
Solución:
El carbono es un elemento químico presente en la naturaleza. Su carácter especial se debe a la capacidad que tiene para unirse a otros átomos de carbono o con otros elementos para formar cadenas largas o cortas, ramificadas, abiertas o cerradas que van desde los compuestos más sencillos, como el metano, con un átomo de carbono; hasta los más complejos como el ADN que posee más de 100 centenas de millones de carbonos.
La rama de la química que se dedica al estudio del carbono se llama química orgánica.
Respuesta correcta opción C.
Reactivo 3
Relacione los compuestos con su grupo correspondiente.
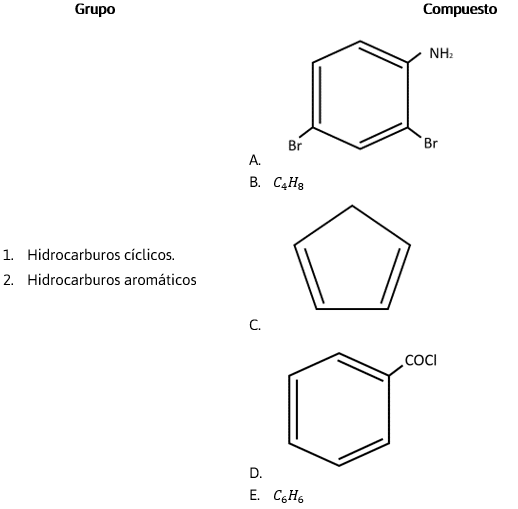
- 1BC, 1ADE
- 1AC, 2BDE
- 1ADE, 2BC
- 1CD, 2ABE
Solución:
Como el enunciado nos dice que relacionemos los hidrocarburos aromáticos o cíclicos con su estructura correspondiente, no es necesario establecer la nomenclatura de cada uno de ellos, sin embargo, sí es importante diferenciarlos uno de otros
¿Cómo se diferencia un hidrocarburo cíclico de uno aromático? Los hidrocarburos cíclicos simplemente son unidades de anillos que pueden ser representados por polígonos en dibujos de esqueleto. Depende del compuesto que se trate son de enlaces sencillos (cicloalcanos), poseen un enlace doble (cicloalquenos) o uno triple (cicloalquinos). Por ejemplo:
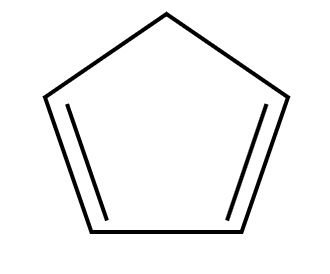
{C}_{4}{H}_{8}
En contraste, los hidrocarburos aromáticos son derivados del benceno ( {\mathit{C}}_{6}{\mathit{H}}_{6}) y tienen una configuración especial. Se representa como un anillo de seis miembros (hexágono) con tres enlaces dobles. Es un arreglo muy estable y puede poseer uno o varios sustituyentes en su cadena carbonada. Ejemplo:
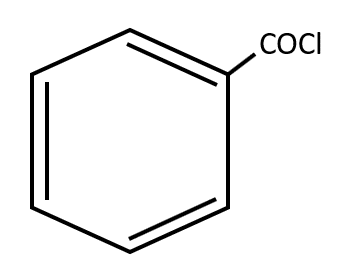
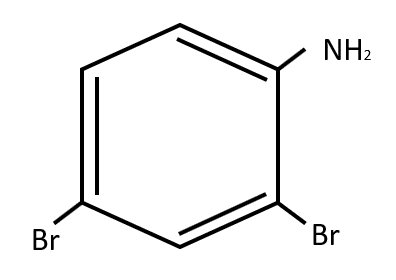
Respuesta correcta opción A.
Reactivo 4
¿Qué símbolo indica la precipitación de un compuesto durante una reacción química?
- ∆
- \downarrow
- \nabla
- \leftrightarrow
Solución:
La simbología es muy importante en las ecuaciones químicas, ya que nos permite comprender cómo sucede y qué está pasando en la reacción. La formación de un precipitado se indica con la flecha hacia abajo \downarrow o (s).
Respuesta correcta opción B.
Reactivo 5
Calcular el peso molecular (g/mol) del compuesto NaHC{O}_{3}
Masas atómicas:
- Na = 23
- H = 1
- C = 12
- O = 16
- 45 g/mol
- 64 g/mol
- 84 g/mol
- 120 g/mol
Solución:
Consideramos las masas atómicas de cada uno de los elementos, que nos brinda el enunciado, y las multiplicamos por la cantidad de átomos de cada elemento presente en el bicarbonato de sodio
- 1 átomo de sodio multiplicado por su masa atómica.
23 g/mol\times 1=23 g/mol
- 1 átomo de carbono (el producto de la multiplicación es el mismo valor que su masa atómica).
12 g/mol\times 1=12g/mol
- 1 átomo de hidrógeno (el producto de la multiplicación es el mismo valor que su masa atómica).
1 g/mol\times 1=1 g/mol
- 3 átomos de oxígeno multiplicado por su masa atómica.
16 g/mol\times 3=48g/mol
PM del bicarbonato de sodio:
PM NaHC{O}_{3}=\left(23+12+48+1\right) g/mol=84 g/mol
PM NaHC{O}_{3}=84 g/mol
Respuesta correcta opción C.
Reactivo 6
Calcular la masa en g de cloruro de hierro producido al utilizar 90 g de FeS con un 90% de pureza:
FeS+2 HCl\to FeC{l}_{2}+{H}_{2}S
- 120 g
- 91 g
- 180 g
- 3 g
Solución:
Como primer paso verificamos si la ecuación está balanceada:

Calculamos el peso molecular del FeC{l}_{2} y del FeS:
- Peso molecular del FeC{l}_{2} : ( \mathrm{55,8}+35.5 \times 2 ) g/mol = 126.8 g/mol
- Peso molecular del FeS: ( \mathrm{55,8}+32 ) g/mol = 87.8 g/mol
Para conocer la masa de cloruro de hierro formado, primero debemos calcular los g puros de FeS:
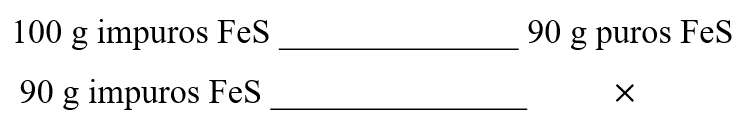
La relación matemática es la siguiente:
90 g impuros FeS\times \frac{90 g puros FeS}{100 g impuros FeS}=81 g puros FeS
- Masa del FeC{l}_{2} a partir de 81 g puros de FeS:
FeS+2 HCl\to FeC{l}_{2}+{H}_{2}S
Según la relación estequiométrica, si 87.8 g de FeS producen 126.8 g de FeC{l}_{2} ¿Cuántos g de FeC{l}_{2} se producen a partir de 81 g puros de FeS?

La relación matemática es:
81 g FeS\times \frac{126.8 g FeC{l}_{2}}{87.8 g FeS}= 120 g
Respuesta correcta opción A.
Reactivo 7
Identificar el tipo de enlace que falta en la siguiente estructura
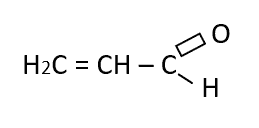
- =
- -
- \equiv
- ⋮⋮
Solución:
El carbono como elemento del grupo IVA puede compartir cuatro electrones de valencia y formar cuatro enlaces covalentes fuertes; además, los átomos de carbono pueden unirse entre ellos y formar cadenas largas y anillos.
En base a ello podemos deducir que el tipo de enlace que falta en la estructura es un enlace doble, para que el carbono señalado comparta 4 electrones:
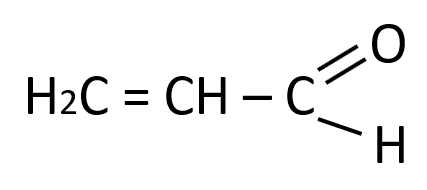
Respuesta correcta opción A.
Reactivo 8
Identifique la función química del siguiente compuesto:
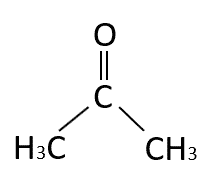
- Aldehído.
- Imina.
- Amina.
- Cetona.
Solución:
En la estructura señalada podemos observar la presencia del grupo carbonilo, lo que indica que puede ser un aldehído o cetona. Se sabe que es una cetona porque el grupo funcional no se halla en el extremo de la molécula, sino en el centro.
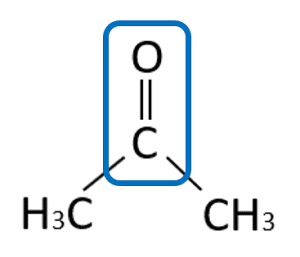
Respuesta correcta opción D.
Reactivo 9
La ________________ es la separación de un enlace, de tal manera que cada átomo conserva uno de los dos electrones del enlace.
- Ruptura simétrica.
- Ruptura heterolítica.
- Ruptura homolítica.
- Ruptura asimétrica.
Solución:
La ruptura homolítica es la separación de un enlace, de tal manera que cada átomo conserva uno de los dos electrones del enlace
Respuesta correcta opción C.
Reactivo 10
¿Cuál es el estado de mayor energía entre los reactivos y los productos?
- De transición.
- Intermedio.
- Intermediario reactivo.
- De activación.
Solución:
Durante el cambio de reactivo a producto que ocurre en las reacciones químicas se produce una barrera, debido a que una molécula de reactante debe cambiar y pasar por un estado de transición de alta energía para formar los productos. Dicha barrera se conoce como energía de activación, la función de las enzimas es disminuir la energía de activación para que el tiempo de reacción disminuya.
Respuesta correcta opción A.
Reactivo 11
Identificar el nombre del compuesto formado por la reacción entre el benceno y el cloruro de acetilo:
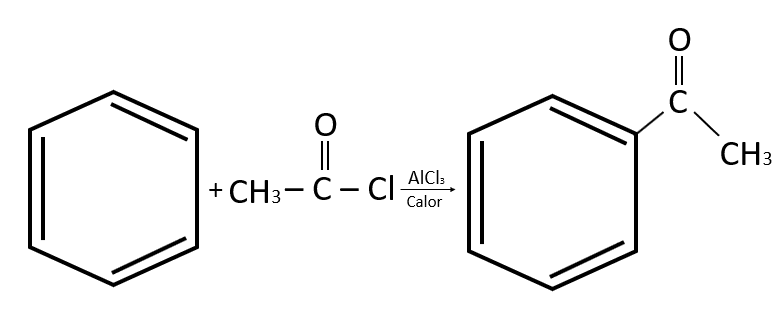
- Acetofenil
- Acetofenona
- Ácido fenólico
- Butanoato de etilo
Solución:
El compuesto formado se caracteriza por la presencia de un grupo fenil y el grupo funcional carbonilo. Como el carbonilo no está ubicado en el extremo de la molécula la función química se trata de una cetona. En este sentido, se tiene la combinación del fenilo con la cetona, originando la 1-feniletanona o acetofenona.
Respuesta correcta opción B.
Reactivo 12
Identificar el tipo de reacción que ocurre en la siguiente ecuación:
3{H}_{2}C=C{H}_{2}+2KMn{O}_{4}+4{H}_{2}O \to 2Mn{O}_{2}\downarrow +2KOH+ 3C{H}_{2}OH-C{H}_{2}OH
- Reducción de un alcano
- Reducción de un alqueno
- Oxidación de un alquino
- Oxidación de un alqueno
Solución:
La identificación de reacciones orgánicas son uno de los reactivos más complicados de resolver, porque el aprendizaje de cada una de ellas es extenso. Pero, existen patrones para identificar lo que sucede de forma sencilla.
El permanganato de potasio es un reactivo que permite la oxidación de un alqueno, rompe el doble enlace. Por lo tanto, la reacción del enunciado tiene la presencia del KMn{O}_{4} que hidroliza el doble enlace del {H}_{2}C=C{H}_{2} originando C{H}_{2}OH-C{H}_{2}OH .
Respuesta correcta opción D.
Reactivo 13
En los procesos isobáricos para una masa determinada de un gas ideal a presión constante, el volumen es directamente proporcional a:
- La temperatura en grados Fahrenheit,
- La temperatura en grados Celsius.
- La temperatura de Kelvin.
- La variación del calor.
Solución:
En los procesos isobáricos para una masa determinada de un gas ideal a presión constante, el volumen es directamente proporcional a la temperatura de Kelvin.
Respuesta correcta opción C.
Reactivo 14
¿Cuál es la normalidad (Eq/L) de una solución de {H}_{2}S{O}_{4} 2,5 M?
- 1.5 Eq/L
- 3 Eq/L
- 5 Eq/L
- 7.5 Eq/L
Solución:
Para realizar la conversión de unidades que pide el enunciado establecemos la siguiente relación matemática:
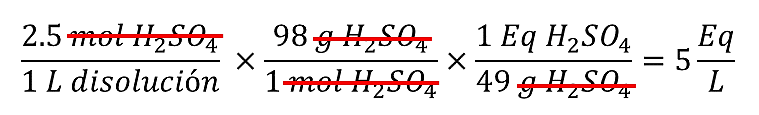
Una forma directa de conseguir la concentración normal a partir de la molaridad, es multiplicar el valor de la normalidad por dos, ya que la normalidad por lo general es el doble de la molaridad. Por ejemplo:
N=2.5 M\times 2=5N
Pero, lo ideal es que realices la conversión matemática paso a paso y luego confirmes el valor multiplicando la molaridad por dos.
Respuesta correcta opción C.
Reactivo 15
La unidad de intensidad de corriente es el:
- Amper.
- Coulombios.
- Faraday.
- Electrón.
Solución:
La unidad de intensidad de corriente es el Amper. Es decir, la variación de carga eléctrica que circula por un conductor respecto al tiempo.
Respuesta correcta opción A.


