Resuelve la segunda versión del examen simulador de química del área de Ingeniería y Cs. Físico Matemáticas y acorta tus tiempos de respuesta para cada reactivo.

Recuerda los puntos clave del examen al IPN:
- Carreras ofertadas en IPN: 70+
- Porcentaje de aceptación: 20%
- Preguntas en el examen de admisión: 140 preguntas
- Nuevos temas: Historia e Inglés (reading comprehension)
- Tipo: selección múltiple
Estructura del examen IPN
Este año la estructura del examen de admisión al Instituto Politécnico Nacional ha cambiado un poco. Y te explicamos cada detalle a continuación:
- El examen evaluará la materia de inglés, específicamente en el tema de Reading comprehension.
- Las materias de competencia escrita y competencia lectora, sustituyeron a producción escrita y comprensión de textos.
- Cada área asigna la cantidad de reactivos por materia.
- Se agregó la materia de historia de México a las tres áreas de estudio.
- El examen para todas las carreras tendrá 140 reactivos (anteriormente eran 130).
El examen de ingreso al IPN se divide en un módulo de conocimientos generales, en el cual las materias son comunes a todas las carreras ofertadas e incluye:
- Matemáticas
- Competencia escrita
- Competencia lectora
- Reading comprehension (nuevo tema)
- Historia
Y, el módulo de conocimientos experimentales que varía de dificultad según la carrera a la que aspiras ingresar. En él se evalúan las siguientes materias:
- Biología
- Química
- Física
La siguiente tabla muestra la estructura de reactivos por materia para cada área:
| Materia | IyCFM | CMB | CSyA |
|---|---|---|---|
| Matemáticas | 37 | 33 | 35 |
| Competencia escrita | 20 | 20 | 25 |
| Competencia lectora | 20 | 20 | 20 |
| Reading comprehension | 10 | 10 | 10 |
| Historia | 10 | 10 | 20 |
| Biología | 9 | 17 | 10 |
| Química | 17 | 17 | 10 |
| Física | 17 | 13 | 10 |
Recuerda que es dificil ser admitido en el IPN, ya que esta institución es una de las más demandadas del país y la competencia para ingresar es muy grande. Por ello, busca apoyo en todas las herramientas que colocamos a tu disposición.
Temario de Química
Los temas de quimica son los mismos para las ramas de Ciencias médico-biológicas (CMB) e Ingeniería y Ciencias físico-matemáticas (IyCFM).
| Tema | Ramas |
|---|---|
| Materia y energía | IyCFM, CMB, CSyA |
| Estructura atómica | IyCFM, CMB, CSyA |
| Elementos de la tabla periódica | IyCFM, CMB, CSyA |
| Enlace químico | IyCFM, CMB, CSyA |
| Nomenclatura química inorgánica | IyCFM, CMB, CSyA |
| Reacciones químicas inorgánicas | IyCFM, CMB, CSyA |
| Reacciones químicas | IyCFM, CMB, CSyA |
| Estequiometría | IyCFM, CMB, CSyA |
| Estructura y nomenclatura de compuestos orgánicos | IyCFM, CMB, CSyA |
| Reacciones químicas de compuestos orgánicos | IyCFM, CMB, CSyA |
| Estado gaseoso | IyCFM, CMB, CSyA |
| Disoluciones | IyCFM, CMB |
| Electroquímica | IyCFM, CMB |
| Termodinámica | IyCFM, CMB |
| Velocidad de reacción y equilibrio químico | IyCFM, CMB |
| Ácidos bases | IyCFM, CMB, CSyA |
¿Cómo resolver el simulacro?
Los enunciados han sido diseñados para que puedas practicar los temas del examen y mejorar el tiempo que tardas en resolverlos. Los exámenes simulacro podrán probar tus conocimientos en condiciones similares a la prueba real para alcanzar los aciertos que necesitas por carrera.
Tips para resolver el simulacro:
- Responde todos los reactivos por tu cuenta antes de comprobar las respuestas.
- Establece un cronómetro de 180 minutos (como la prueba real).
- Trata de tener unos minutos de sobra para comprobar tus respuestas.
- No te detengas por un ejercicio complejo, salta al siguiente y regresa a él en el momento oportuno.
- Los reactivos de química pueden parecer complejos, pero la práctica te dará la destreza.
Reactivo 1
El elemento ____________ se usa para la fabricación de vidrios siliconas y materiales de construcción como el cemento.
- Carbono.
- Manganeso.
- Silicio.
- Azufre.
Solución:
El silicio es el principal componente de uno de los materiales más versátiles de la civilización, el vidrio. El cual se componen de la fusión de diversos materiales orgánicos, pero principalmente óxido de silicio ( Si{O}_{2} ). El silicio también se utiliza en la fabricación de esmaltes, cerámicas y materiales de construcción como el cemento.
Respuesta correcta opción C.
Reactivo 2
Rama de la química que se encarga de estudiar las reacciones que implican cambios en el núcleo atómico.
- Química cuántica.
- Química nuclear.
- Química analítica.
- Química descriptiva.
Solución:
La química nuclear dio sus primeros pasos gracias a Antoine Becquerel con el descubrimiento de la radiactividad natural, luego de ello fue impulsada por investigadores de reconocimiento mundial como Marie Curie y su esposo Pierre Curie. Dicha rama de la química estudia la naturaleza de las reacciones nucleares.
La radiactividad es el fenómeno que se observa en los núcleos inestables de algunos átomos que emiten espontáneamente partículas o algún tipo de radiación electromagnética. Las aplicaciones de la química nuclear generan desconfianza en la mayoría de la población debido al peligro que representan para la vida los desechos radiactivos.
Respuesta correcta opción B.
Reactivo 3
¿Cuál es el nombre del siguiente compuesto representado en fórmula taquigráfica?
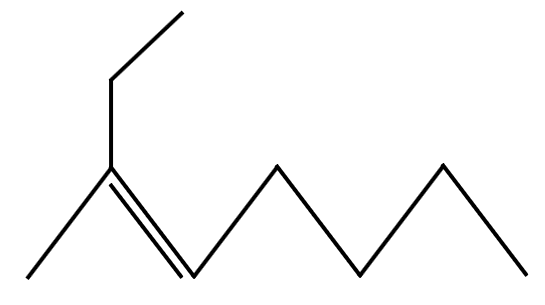
- 2-etil-2-hepteno
- 2,2-etilhexeno
- 2-metil-2-hexeno
- Dietilhepteno
Solución:
La nomenclatura de los compuestos representados de forma taquigráfica es muy sencilla, cada pico o punto de unión representa un carbono y los agregados a la cadena principal son sustituyentes como se muestra a continuación:
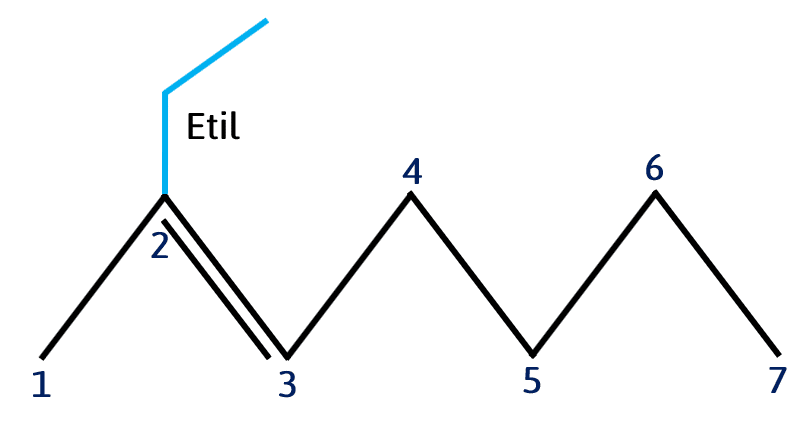
- La cadena principal está formada por 7 carbonos.
- En el carbono 2 presenta un doble enlace, por lo que se trata de un alqueno.
- Y en el carbono dos tiene un radical alquilo de dos carbonos: etil o etilo
Uniendo cada información que nos brinda la representación taquigráfica del compuesto, el nombre correcto es:
2-etil-2-hepteno
Respuesta correcta opción A.
Reactivo 4
Seleccionar la reacción química en donde se indica la precipitación del carbonato de calcio
- Ca{\left(OH\right)}_{2}+MgC{O}_{3} \to CaC{O}_{3}\downarrow +Mg{\left(OH\right)}_{2}
- Ca{\left(OH\right)}_{2}+MgC{O}_{3} \to CaC{O}_{3}\uparrow +Mg{\left(OH\right)}_{2}
- Ca{\left(OH\right)}_{2}+MgC{O}_{3} \to CaC{O}_{3} +Mg{\left(OH\right)}_{2}\downarrow
- Ca{\left(OH\right)}_{2}+MgC{O}_{3} \to CaC{O}_{3}+Mg{\left(OH\right)}_{2}\uparrow
Solución:
En las reacciones químicas la precipitación de un compuesto durante la reacción se representa con el símbolo \downarrow o así (s), por lo tanto, es sencillo verificar que la única opción del enunciado que demuestra la precipitación del CaC{O}_{3} es la A.
Ca{\left(OH\right)}_{2}+MgC{O}_{3} \to CaC{O}_{3}\downarrow +Mg{\left(OH\right)}_{2}
Respuesta correcta opción A.
Reactivo 5
Calcular el peso molecular (g/mol) del hidróxido de amonio: N{H}_{4}OH.
Considerando las masas atómicas (g): N = 14; H = 1; O = 16
- 30 g/mol
- 34 g/mol
- 35 g/mol
- 40 g/mol
Solución:
Consideramos las masas atómicas de cada uno de los elementos, que nos brinda el enunciado y las multiplicamos por la cantidad de átomos de cada elemento presente en el hidróxido de amonio.
- 1 átomos de nitrógeno multiplicado por su masa atómica (el producto de la multiplicación es el mismo valor que su masa atómica):
14 g/mol\times 1=14 /mol
- 5 átomos de hidrógeno multiplicado por la masa atómica del elemento:
1 g/mol\times 5=5 g/mol
- 1 átomo de oxígeno multiplicado por su masa atómica.
16 g/mol\times 1=16 g/mol
PM del carbonato de sodio:
PM N{H}_{4}OH=\left(14+5+16\right) g/mol=35g/mol
PM N{H}_{4}OH=35 g/mol
Respuesta correcta opción C.
Reactivo 6
30 g de piedra caliza ( CaC{O}_{3}) tienen una pureza del 80% lo que significa que ________ g de CaC{O}_{3} corresponden a piedra caliza pura siendo el resto impurezas inertes.
- 12
- 24
- 48
- 36
Solución:
Para conocer los g puros del carbonato de calcio establecemos el siguiente análisis:
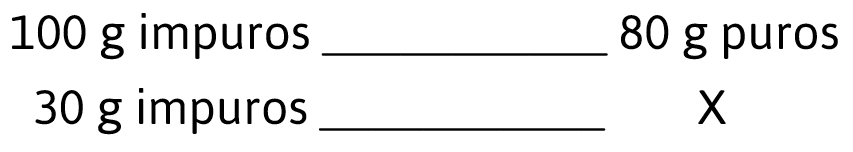
100 g impuros de CaC{O}_{3} hay 80 g puros, en 30 g del mismo compuesto ¿Cuántos gramos puros hay?
La relación matemática es la siguiente:
30 g impuros CaC{O}_{3}\times \frac{80 g puros CaC{O}_{3}}{100 g impuros CaC{O}_{3}}=24 g puros de CaC{O}_{3}
30 g de piedra caliza ( CaC{O}_{3}) tienen una pureza del 80% lo que significa que 24 g de \mathit{C}\mathit{a}\mathit{C}{\mathit{O}}_{3} corresponden a piedra caliza pura siendo el resto impurezas inertes.
Respuesta correcta opción B.
Reactivo 7
Indique la especie química faltante en el recuadro de la siguiente estructura
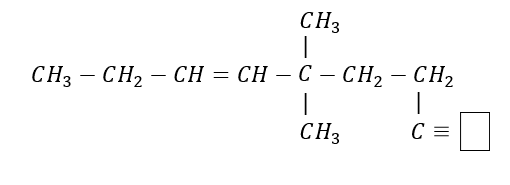
- C
- C{H}_{3}
- CH
- C{H}_{2}
Solución:
El carbono como elemento del grupo IVA, puede compartir cuatro electrones de valencia y formar cuatro enlaces covalentes fuertes; además, pueden unirse entre ellos y formar cadenas largas y anillos.
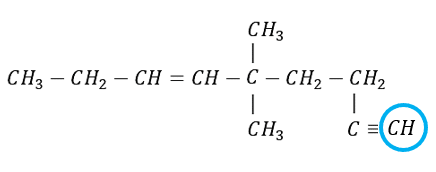
La especie faltante es un CH, debido a que el último carbono formar un enlace triple con el C anterior y uno sencillo con el H.
Respuesta correcta opción C.
Conoce todo sobre el siguiente proceso de selección: Convocatoria IPN 2023.
Reactivo 8
Identificar el tipo de función química del siguiente compuesto
C{H}_{3}-O-C{H}_{2}-C{H}_{3}
- Éster.
- Éter.
- Alcohol.
- Aldehído.
Solución:
El compuesto orgánico que presenta el enunciado es un etil metil éter o metoxietano. Por lo tanto, pertenece al grupo funcional éter.
Los éteres son sencillos de identificar debido a que siempre tienen un oxígeno ( -O-) solitario.
Respuesta correcta opción B.
Reactivo 9
Un _______________, es una molécula o un fragmento de una molécula que se forma en una reacción y existe por un corto tiempo antes de que reaccione en el siguiente paso.
- Radial libre.
- Nucleófilo.
- Electrófilo.
- Intermediario.
Solución:
Un intermediario, es una molécula o un fragmento de una molécula que se forma en una reacción y existe por un corto tiempo antes de que reaccione en el siguiente paso.
Son de gran importancia en las reacciones químicas orgánicas, permiten la eliminación o adición de compuestos, son pasos necesarios para la evolución de una reacción, sirven como desactivadores de algunos grupos funcionales, facilitan la transformación de las moléculas, orientan el curso de una reacción química y más.
Respuesta correcta opción D.
Reactivo 10
De las siguientes reacciones, seleccione la que genera un proceso exotérmico
- 4N{H}_{3 \left(g\right)}+5{O}_{2 \left(g\right)}\to 4N{O}_{ \left(g\right)}+6{H}_{2}{O}_{ \left(g\right) } ∆H=-904 kJ/mol
- 4N{H}_{3 \left(g\right)}+5{O}_{2 \left(g\right)}\to 4N{O}_{ \left(g\right)}+6{H}_{2}{O}_{ \left(g\right) } ∆H=+904 kJ/mol
- 2{H}_{2}{O}_{ \left(g\right)} \to 2{H}_{2 \left(g\right)}+{O}_{2 \left(g\right)} ∆H=+436 kJ/mol
- 2{H}_{2}{O}_{ \left(g\right)} \to 2{H}_{2 \left(g\right)}+{O}_{2 \left(g\right)} ∆H=0 kJ/mol
Solución:
El contenido calórico de toda especie química es constante para condiciones determinadas y estado físico específico, cuando ocurre un cambio químico se genera un cambio energético.
La variación de la entalpía ( ∆H ) en un sistema termodinámico es una magnitud extensiva, es decir, que es proporcional a la cantidad de sustancia que se produce. El valor de ∆H se consigue con las diferencias de entalpías contenidas en los productos y reactantes.
- Cuando el valor de ∆H es negativo se genera un proceso exotérmico.
- Cuando el valor de ∆H es positivo se genera un proceso endotérmico.
En este sentido la reacción en la que se genera un proceso exotérmico es:
4N{H}_{3 \left(g\right)}+5{O}_{2 \left(g\right)}\to 4N{O}_{ \left(g\right)}+6{H}_{2}{O}_{ \left(g\right) }
Porque el valor de ∆H es negativo -904 kJ/mol
Respuesta correcta opción A.
Reactivo 11
Nombre del compuesto principal que se obtiene como producto
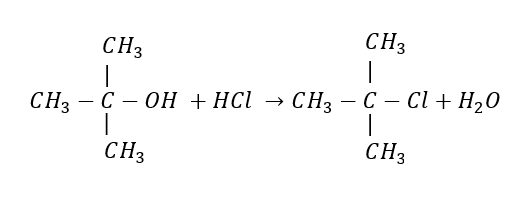
- Cloruro de sec-butilo
- Cloropropano
- Cloruro de ter-butilo
- Alcohol ter-butílico
Solución:
Aunque el agua también se forma entre los productos de la reacción, no es el producto de interés sino el cloruro de ter-butilo el cual resulta de la unión del radical alquilo ter-butilo y un átomo de cloro.
Respuesta correcta opción C.
Reactivo 12
Identificar el tipo de reacción en la siguiente ecuación
C{H}_{3}-C{H}_{2}-C{H}_{3 \left(g\right)}+5{O}_{2 \left(g\right)} \stackrel{∆}{\to } 3C{O}_{2 \left(g\right)}+4{H}_{2}{O}_{ \left(l\right)}+calor
- Combustión del benceno.
- Alquilación de radicales libres.
- Halogenación de un alcano.
- Combustión de un alcano.
Solución:
La reacción guarda las siguientes características:
C{H}_{3}-C{H}_{2}-C{H}_{3 \left(g\right)}+5{O}_{2 \left(g\right)} \stackrel{∆}{\to } 3C{O}_{2 \left(g\right)}+4{H}_{2}{O}_{ \left(l\right)}+calor
Se utiliza un alcano que en presencia de oxígeno y calor produce dióxido de carbono, agua y libera energía. En este sentido, se concluye que es una reacción de combustión de un alcano.
Respuesta correcta opción D.
Reactivo 13
Seleccione el ejemplo que corresponde con un proceso isobárico:
- Hervir agua en un recipiente sin tapa.
- Hervir agua en un recipiente hermético.
- Dejar enfriar el agua a temperatura ambiente.
- Alcanza el punto de congelación del agua.
Solución:
Hervir el agua en un recipiente sin tapa es un proceso isobárico, debido a que la sustancia dentro del recipiente experimenta en su superficie la presión atmosférica, la cual es constante.
Respuesta correcta opción A.
Reactivo 14
¿Cuál es el peso equivalente del {H}_{3}P{O}_{4} ? Considerando las masas atómicas (g): H = 1; P = 31; O = 16
- 32.6 g/eq
- 48 g/eq
- 98 g/eq
- 49 g/eq
Solución:
La fórmula para calcular el peso equivalente es la siguiente:
Peq=\frac{PM}{\# {H}^{+}}
Para sustituir los valores debemos calcular el peso molecular del {H}_{3}P{O}_{4} :
PM del {H}_{3}P{O}_{4}=\left(1\times 3\right)+\left(31\times 1\right)+\left(16\times 4\right)=98 g/mol
PM del {H}_{3}P{O}_{4} = 98 g/mol
Sustituimos los valores:
Peq=\frac{98 g/mol}{3 eq/mol}=32.6 g/eq
Respuesta correcta opción A.
Reactivo 15
Un __________________ afecta notoriamente la conducción electrolítica (en solución) debido a la mayor movilización de los iones por el aumento de su contenido energético.
- Descenso de la temperatura.
- Aumento del pH.
- Aumento de la temperatura.
- Descenso del pH.
Solución:
Un aumento de la temperatura afecta notoriamente la conducción electrolítica (en solución) debido a la mayor movilización de los iones por el aumento de su contenido energético.
Respuesta correcta opción C.

