¡Hola de nuevo aspirante! Vamos a resolver los ejercicios del 31 al 40, correspondientes a la cuarta parte del simulacro de química, para el examen de ingreso al IPN en el área de Ingeniería y Ciencias Físico – Matemáticas.

La recomendación principal es que resuelvas los ejercicios por tu cuenta antes de mirar la solución. Esta técnica te ayudará a mejorar tus tiempos de respuesta, a afianzar conocimientos y, lo más importante, te brindará seguridad a la hora de contestar tu prueba de admisión al IPN.
Reactivo 31: Enlace químico
Seleccione los compuestos que se mantienen unidos mediante enlace iónico:
- CdS{O}_{4}
- {C}_{5}{H}_{10}
- C{H}_{3}OH
- KBr
- MgC{l}_{2}
- 1, 2, 3
- 1, 4, 5
- 1, 3, 5
- 2, 3, 5
Solución:
El enlace iónico se da entre iones, un catión que ha perdido electrones y un anión que ha ganado electrones. Entre ellos se crea una fuerza de atracción gracias a sus cargas eléctricas opuestas. Ejemplo de dichos enlaces son:
- Sulfato de cadmio, anión sulfato unido al catión cadmio \left(CdS{O}_{4}\right)
- Bromuro de potasio, catión potasio junto al anión bromuro \left(KBr\right) .
- Cloruro de magnesio \left(MgC{l}_{2}\right) igualmente un compuesto iónico.
Respuesta correcta opción B.
Reactivo 32: Estructura atómica
Diga cuántos electrones participan en la formación del enlace del gas oxígeno.
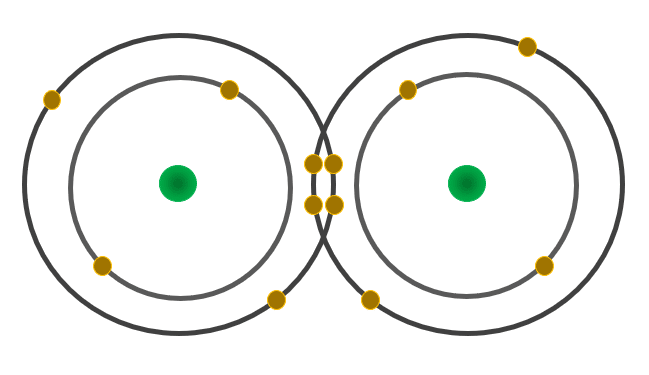
- 6
- 4
- 2
- 12
Solución:
Los enlaces covalentes, como el que posee la molécula de oxígeno gaseoso, se forman cuando los átomos comparten electrones ubicados en su última capa de energía. En este caso, cada átomo de oxígeno comparte un par de electrones, como se observa en la imagen:
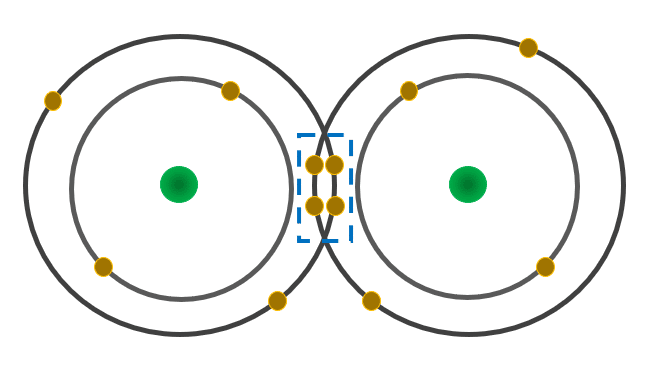
Al compartir un par de electrones los átomos se completan su octeto de electrones. Necesarios para alcanzar la estabilidad con la configuración electrónica de un gas noble (como lo expresa la regla del octeto).
La respuesta correcta es la opción B.
Reactivo 33: Estructura atómica
Seleccione el diagrama de orbital correcto para la configuración electrónica 1{s}^{2}2{s}^{2} en estado fundamental del berilio.
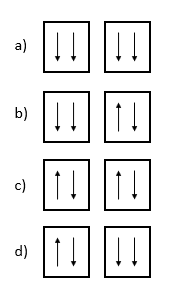
Solución:
Un orbital atómico solo acepta dos electrones, los cuales deben tener un spin opuesto según el principio de exclusión de Pauli. Por lo tanto, el diagrama de orbital correcto para el átomo de berilio \left(1{s}^{2}2{s}^{2}\right) será:
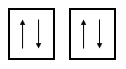
Los electrones en cada orbital se encuentran con spin opuesto.
La respuesta correcta es la opción C.
Reactivo 34: Nomenclatura de compuestos inorgánicos
Relacione los nombres con sus fórmulas químicas correspondientes:

- 1D, 2C, 3A, 4B
- 1B, 2A, 3D, 4C
- 1A, 2B, 3C, 4D
- 1A, 2B, 3D, 4C
Solución:
Resolver este tipo de ejercicio la mayoría de las veces supone un problema, debido a que los compuestos inorgánicos tienen una extensa nomenclatura y los átomos que se combinan pueden utilizar diferentes tipos de valencia. Sin embargo, relacionemos cada uno de los compuestos con su nombre correcto de una forma sencilla.
El sulfato niqueloso es la combinación de níquel con valencia +2 más el ion sulfato, en este caso corresponde con la fórmula NiS{O}_{4}
El borato de calcio, es la combinación del calcio con valencia +2 junto al anión borato (B{O}_{3}{)}^{\equiv } . El compuesto resultante es C{a}_{3}{\left(B{O}_{3}\right)}_{2}
El hidruro de rubidio, pertenece a los compuestos constituidos por un elemento metálico unido al hidrógeno con valencia – 1. La fórmula para ello es RbH
El hidróxido de estaño se reconoce por la presencia del grupo hidroxilo ( OH ), combinado con el Sn de valencia +2. Fórmula Sn{\left(OH\right)}_{2}
Las relaciones correctas son: 1A, 2B, 3D, 4C. Respuesta correcta opción D.
Reactivo 35: Estequiometría
¿Cuántos moles de cloro gaseoso serán necesarios para producir 8 moles de cloruro férrico?
2Fe+3C{l}_{2} \to 2FeC{l}_{3}- 6
- 12
- 8
- 16
Solución:
Según la reacción química expresada en el enunciado, con 3 moles de cloro gaseoso se producen 2 moles de cloruro férrico.
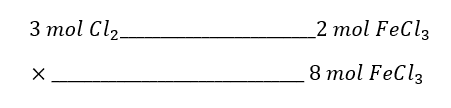
¿Cuántos moles de C{l}_{2} serán necesarios para producir 8 moles de cloruro férrico?
La relación matemática es la siguiente:
moles de C{l}_{2}=8 mol FeC{l}_{3} \bullet \frac{3 mol C{l}_{2}}{2 mol FeC{l}_{3}}=12 mol C{l}_{2}
Se necesitan 12 moles de C{l}_{2} para generar 8 moles de cloruro férrico.
Respuesta correcta opción B.
Reactivo 36: Elementos de la tabla periódica
Los elementos libres en las ecuaciones químicas, como el nitrógeno, oxígeno, flúor y cloro se presentan como:
- Moléculas diatómicas.
- Especie monoatómica.
- Fórmula empírica sencilla.
- Solo el símbolo del elemento.
Solución:
En las ecuaciones químicas, cuando se observan elementos individuales muchos se representan en su forma empírica, como por ejemplo el Fe. Pero, para algunos elementos no sucede lo mismo. Los que menciona el enunciado existen en el ambiente como moléculas diatómicas, por lo tanto, en las ecuaciones químicas se escriben como {N}_{2} , {O}_{2} , {F}_{2} y C{l}_{2} cuando se encuentran libres.
La respuesta correcta es la opción A.
Reactivo 37: Elementos de la tabla periódica
Señale los elementos que poseen un radio atómico de mayor tamaño que el calcio.
- Cloro, flúor y azufre.
- Potasio, cloro y flúor.
- Potasio, rubidio y cesio.
- Magnesio, litio y sodio.
Solución:
El radio atómico varía con la posición de los elementos dentro de la tabla periódica.
- Aumenta de derecha a izquierda en los periodos.
- Aumenta de arriba hacia abajo en los grupos.
El calcio se encuentra en el grupo II – A y en el período 4, los elementos ubicados hacia la derecha o por encima de él tendrán un radio atómico inferior, como es el caso del cloro, flúor, y azufre, ubicados en grupos superiores hacia la derecha. El litio y el sodio, aunque pertenecen al grupo I – A se encuentran en los períodos 2 y 3, por lo tanto, sus radios atómicos también serán inferiores. El magnesio se halla en el grupo II – A en el periodo 3, por ello también tiene un radio atómico menor al del calcio.
Los únicos elementos mencionados en el enunciado que tienen un radio atómico superior al del calcio son el potasio, rubidio y cesio, pertenecen al grupo I – A y se hallan en los periodos 4, 5 y 6 respectivamente. Es decir, están más hacia la izquierda en la tabla periódica.
Respuesta correcta opción C.
Reactivo 38: Reacciones químicas
Seleccione la reacción en la que se obtiene como producto perclorato de potasio:
- KOH+HN{O}_{3} \to KN{O}_{3}+{H}_{2}O
- KCl{O}_{3} \to KCl+\frac{3}{2}{O}_{2}
- K+\frac{1}{2}{O}_{2}\to {K}_{2}O
- 4KCl{O}_{3}\to 3KCl{O}_{4}+KCl
Solución:
El perclorato de potasio es un compuesto formado por la unión del catión potasio con el anión perclorato (Cl{O}_{4}{)}^{-} . La única reacción que posee el compuesto indicado es:

La respuesta correcta es la opción D.
Reactivo 39: Nomenclatura química inorgánica
Seleccione el compuesto en el cual el hidrógeno se encuentra como ion hidruro.
- NaOH
- HCl
- NaH
- HBr
Solución:
El hidrógeno trabaja con la valencia +1 en la mayoría de los compuestos. Sin embargo, cuando se encuentra formando hidruros, hidrógeno más metal, su valencia será – 1 (ion hidruro). Por ejemplo, el hidruro de sodio (NaH).
Respuesta correcta opción C.
Reactivo 40: Reacciones químicas
Cuando el hidrógeno se quema en el aire ¿Qué compuesto se obtiene?
- Agua.
- Hidróxido de sodio.
- Ozono.
- Grupos hidroxilos.
Solución:
El compuesto más importante que forma el hidrógeno es el agua. Se obtiene cuando se quema en el aire en presencia de oxígeno:
2{H}_{2\left(g\right)}+{O}_{2\left(g\right)}\to 2{H}_{2}{O}_{\left(l\right)}La respuesta correcta es la opción A.


