¡Felicidades aspirante! Llegaste a la quinta y última parte del simulacro de química para el área de Ingeniería y Ciencias Físico – Matemáticas del Instituto Politécnico Nacional.

Los siguientes 10 reactivos son los últimos por ahora. Evalúa tus tiempos de respuesta, vuelve a intentarlo y verás el resultado.
Reactivo 41: Reacciones químicas
Seleccione los coeficientes correspondientes para la siguiente ecuación química:
{N}_{2}{O}_{5 \left(s\right)}+{H}_{2}{O}_{\left(l\right)} \to HN{O}_{3 \left(ac\right)}
- 1 – 1 – 5
- 2 – 1 – 1
- 1 – 1 – 2
- 1 – 3 – 5
Solución:
Para balancear la siguiente ecuación necesitamos conocer la cantidad de átomos que existen a ambos lados de la reacción:
{N}_{2}{O}_{5 \left(s\right)}+{H}_{2}{O}_{\left(l\right)} \to HN{O}_{3 \left(ac\right)}
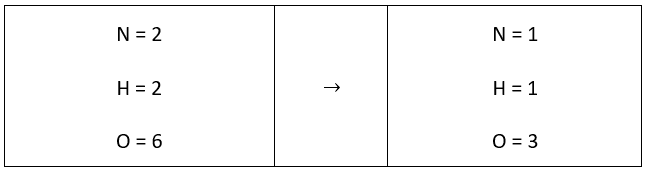
En efecto la reacción no está balanceada, a través del método de tanteo colocamos un número que multiplicado por los subíndices iguale la cantidad de átomos a ambos lados de la reacción.
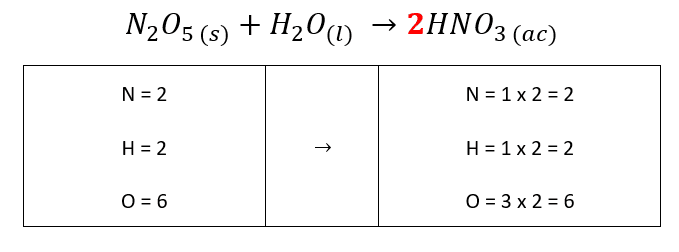
De esta manera la ecuación se halla balanceada, la cantidad de átomos a ambos lados de la reacción es igual. Los coeficientes correctos son: 1 – 1 – 2. Respuesta correcta opción C.
Reactivo 42: Termodinámica
Característica principal observable en la reacción de formación de glucosa, a partir de agua y C{O}_{2} que tiene lugar durante la fotosíntesis:
4 C{O}_{2}+6{H}_{2}O \to {C}_{6}{H}_{12}{O}_{6}+6{O}_{2} ∆{H}^{°}=2801 kJ/mol- Reacción exotérmica.
- Reacción de combustión.
- Libera calor al medio.
- Reacción altamente endotérmica.
Solución:
La ganancia o pérdida de energía calórica que tiene lugar en un proceso determinado se relaciona de forma directa con el contenido energético que presentan las especies químicas antes y después de la reacción. La entalpía (H) es el contenido calórico de una especie química. Su medición se realiza a través de las variaciones de energía producidas en un proceso, ya que la medición directa no tiene lugar.
Cuando la variación de la energía o del contenido calórico tiene un valor positivo, la reacción consume energía, es decir, absorbe calor.
La reacción de formación de glucosa durante el proceso de fotosíntesis tiene un valor muy alto para la variación de la entalpía ( ∆{H}^{°}=2801 kJ/mol ), lo que quiere decir que es una reacción altamente endotérmica.
Respuesta correcta opción D.
Reactivo 43: Disoluciones
Proceso por el cual las moléculas experimentan una transición directa de vapor a sólido.
- Sublimación.
- Cromatografía.
- Deposición.
- Cristalización.
Solución:
La deposición es el proceso inverso de la sublimación, en ella las partículas en estado gaseoso pasan directamente al estado sólido sin atravesar el estado líquido. La respuesta correcta es la opción C.
Reactivo 44: Materia y energía
Seleccione la opción que contenga únicamente ejemplos de fenómenos físicos:
- Fundir metales, corrosión de metales, ruptura del vidrio.
- Combustión del metano, fermentación de alcoholes, rasgar el papel.
- Rasgar el papel, combustión del butano, oxidación de metales.
- Fundir metales, evaporar agua, congelar líquidos.
Solución:
Durante los fenómenos químicos las sustancias no pierden sus propiedades originales. Es decir, su transformación no es irreversible. Por ejemplo, cuando fundir metales como el oro, hierro y plata; cambiar el estado de agregación del agua al evaporarla o congelarla.
Ejemplos como, corrosión de metales, combustión y fermentación son fenómenos químicos en el que las sustancias sufren cambios permanentes.
La única opción que posee fenómenos físicos es la D.
Reactivo 45: Reacciones químicas
¿Cuál es el producto de la descomposición de peróxido de hidrógeno?
- Oxígeno e hidrógeno.
- Agua y oxígeno.
- Plasma y oxígeno.
- Agua y plasma.
Solución:
La descomposición del peróxido de hidrógeno ( {H}_{2}{O}_{2} ) tiene lugar mediante la siguiente reacción química:
2{H}_{2}{O}_{2 \left(ac\right)} \to 2{H}_{2}{O}_{\left(l\right)}+{O}_{2 \left(g\right)}Cuando el peróxido de hidrógeno se descompone se libera agua y oxígeno.
La respuesta correcta es la opción B.
Reactivo 46: Reacciones químicas
Indique los números de oxidación de cada elemento antes y después de la reacción
2 N{O}_{\left(g\right)}+{O}_{2 \left(g\right)} \to 2 N{O}_{2 \left(g\right)}
- +2-2, 0, +4-2
- -2-2, +1, -2+4
- +1-1, +2, +2+4
- +1-1, 0, +2-2
Solución:
Los números de oxidación para la reacción dada en el enunciado serán los siguientes:
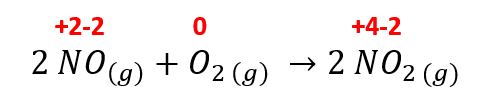
Recuerda que los elementos que se encuentran sin combinar tienen un valor de 0 como número de oxidación.
La respuesta correcta es la opción A.
Reactivo 47: Reacciones químicas
Seleccione la reacción química en la que se refleje la síntesis de amoniaco:
- {H}_{2}O+C \to C{O}_{2}+{H}_{2}
- 4N{H}_{3}+5{O}_{2}\to 4NO+6{H}_{2}O
- {N}_{2}+3{H}_{2} \to 2N{H}_{3}
- S+{O}_{2} \to S{O}_{2}
Solución:
La fórmula química del amoniaco es N{H}_{3} , en el que el nitrógeno tiene un par de electrones libres (no apareados). La única reacción presente en el enunciado que refleja al amoniaco como producto es
{N}_{2}+3{H}_{2} \to 2N{H}_{3}
Por lo tanto, la respuesta correcta es la opción C.
Reactivo 48: Compuestos inorgánicos
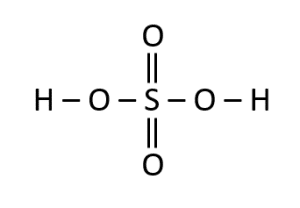
Seleccione la estructura correspondiente para el ácido sulfuroso:
Solución:
El ácido sulfuroso se corresponde con la fórmula {H}_{2}S{O}_{3} , por lo que se debe tener cuidado de confundirlo con el ácido sulfúrico que lleva por fórmula {H}_{2}S{O}_{4} .
La estructura del ácido sulfuroso debe tener la presencia de:
- Dos átomos de hidrógeno.
- Un átomo de azufre.
- Tres átomos de oxígeno.
Como la molécula:
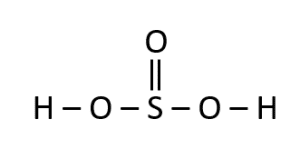
La respuesta correcta es la opción B.
Reactivo 49: Elementos de la tabla periódica
El carácter metálico de los elementos disminuye al aumentar el _____________.
- Número atómico.
- Radio atómico.
- Punto de ebullición.
- Punto de fusión.
Solución:
El carácter metálico de los elementos en la tabla periódica disminuye de izquierda a derecha al aumentar el número atómico. Y en los grupos, por lo general, aumenta de arriba hacia abajo.
Por ejemplo, en el período 3 el elemento más metálico es el sodio y el menos metálico es el argón. En otras palabras, el carácter metálico aumenta de derecha a izquierda.
La respuesta correcta es la opción A.
Reactivo 50: Electroquímica
Cuantas cargas positivas posee el catión calcio:
- +1
- +2
- +3
- +4
Solución:
El calcio se encuentra en el grupo II – A de la tabla periódica. Su valencia es 2, cuando se encuentra como catión posee dos cargas positivas (+2), debido a que la carga eléctrica de los iones también representa su valencia.
La respuesta correcta es la opción B.