En este port vamos a aprender a resolver el siguiente ejercicio:
En el \mathrm{NH}_{3} ¿Cuál es la hibridación del nitrógeno?
Primero que nada vamos a repasar algunos conceptos fundamentales sobre la hibridación y las formas moleculares.
En ciertas ocasiones, los electrones necesarios para la formación de un enlace químico se encuentran formando parejas dentro de los orbitales del átomo al cual pertenecen. Ellos logran separarse con una pequeña absorción de energía, para formar enlaces con otros elementos.
Promoción electrónica
La promoción electrónica es el paso de un electrón que se encuentra apareado en un orbital, hacia el orbital más cercano que se encuentre vacío.
En este sentido, la teoría de repulsión de los pares de electrones en la capa de valencia, es una vía fácil para entender los ángulos de enlace formados en los compuestos orgánicos. La definición dice: Los pares de electrones se repelen entre sí, por lo tanto los electrones no enlazados y los enlaces están separados por ángulos lo más abiertos posible.
Lo que quiere decir que los orbitales sencillos s y p en las moléculas orgánicas no están orientados 90° cada uno, como se espera. Si no que se separan lo más que pueden “repeliéndose” unos con otros enlaces o electrones no enlazados.
En esta guía encontrarás un breve resumen que te ayudará a entender cómo se comportan las moléculas orgánicas para formar enlaces.
Orbitales moleculares
El orbital molecular de enlace es una zona del de alta densidad electrónica. Porque es en ese lugar en donde interactúan las cargas de los átomos que están formando una unión. Cuando el intercambio es simétrico, el enlace se denomina sigma (enlace σ).
- Los orbitales moleculares de enlace se forman por la unión de dos átomos diferentes
Los enlaces sigma son los más comunes entre los compuestos orgánicos. Representan los enlaces sencillos que vez con frecuencia en las cadenas ramificadas de los alcanos. Y cada enlace doble o triple contiene un enlace σ.
- Cuando interactúan entre sí los orbitales de un mismo átomo se forman los orbitales atómicos híbridos y son los que definen la geometría de los enlaces.
Orbitales híbridos sp
Es la unión de los orbitales s y p de un mismo átomo concentrando toda la densidad electrónica en una sola dirección. Generan un ángulo de 180° y separan los electrones de enlace lo más que se puede, quedando en un plano lineal uno orientado hacia la derecha y otro hacia la izquierda.
Orbitales híbridos sp2
Es el resultado de la combinación de un orbital s con dos orbitales p. Tienen una geometría triangular plana ya que los ángulos de enlace están ubicados a 120° uno de otro.
Orbitales híbridos sp3
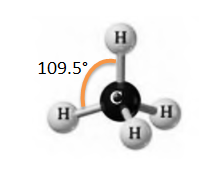
Tienen un arreglo tetraédrico y se forman por la combinación de un orbital s con tres orbitales p. Muchos compuestos orgánicos tienen átomos de carbono formando enlaces a otros cuatro átomos. Esta disposición se conoce como tetraédrica y la separación entre los enlaces forma ángulos de 109.5°
El ejemplo más conocido de orbitales sp^{3} es el del metano (\mathrm{CH}_{4}) Los cuatro electrones de valencia del carbono más uno de cada hidrogeno le da ocho electrones de valencia al metano, según la estructura de Lewis, los cuales corresponden a cuadro enlaces sencillos C―H y cada enlace está separado uno de otro en ángulos de 109.5°
La estructura de Lewis es una manera de simbolizar los enlaces covalentes de una molécula. Cada electrón de valencia se representa con puntos alrededor del elemento. Un par de electrones de enlace se representa con dos puntos o con un guion (―).
Debes tener en cuenta algunas consideraciones para la resolución de ejercicios en los que debes determinar la hibridación de los orbitales s y p presentes en una molécula orgánica:
- Los electrones del enlace sencillo σ y los pares de electrones no enlazados de un átomo pueden ocupar orbitales híbridos. De esta manera, al sumar el número de enlaces sigma con los pares de electrones no enlazados puedes conocer el total de orbitales híbridos
- El primer enlace con otro átomo siempre es un enlace sigma
- El número de orbitales híbridos obtenidos es igual al número de orbitales atómicos combinados
- Los ángulos de enlace se reducen cuando hay un par de electrones no enlazados, ya que estos últimos ocupan más espacio
- Si dos o tres pares de electrones forman un enlace doble o triple el primero siempre es un enlace sigma (orbital hibrido), mientras que el segundo y el tercero son enlaces pi (no hibridados)
- Los electrones no enlazados son electrones de valencia que no se comparten en la formación de enlaces y esto le da estabilidad a la molécula
- Los átomos de oxígeno, nitrógeno y halógenos generalmente tienen electrones no enlazados en sus compuestos estables
Resuelve el siguiente ejercicio para afianzar los conocimientos:
En el \mathrm{NH}_{3} ¿Cuál es la hibridación del nitrógeno?
- sp
- \mathrm{sp}^{2}
- \mathrm{sp}^{3}
- \mathrm{sp}^{3}d
Analizamos:
- Repasa la teoría estudiada
La hibridación del átomo de nitrógeno en el amoníaco depende del número de enlaces sencillos más la presencia de los pares de electrones no enlazados.
Si recuerdas, el nitrógeno solo puede compartir tres pares de electrones y necesita mantener un par de electrones no enlazados para que la molécula formada sea estable.

- Como puedes observar hay tres enlaces sencillos y un par de electrones no enlazados
- Por lo tanto, se necesitan cuatro orbitales híbridos. Lo que significa una hibridación sp^{3}
- Es decir, una geometría tetraédrica alrededor del átomo de nitrógeno.
La respuesta correcta es la opción C
Era muy sencilla ¡Felicitaciones!
Información adicional acerca del ejercicio en relación a la estructura tetraédrica:
Como ves, la estructura del amoníaco es parecida a la del metano solo que con un par de electrones no enlazados presente. Por lo tanto, el ángulo entre los enlaces H―N no tienen un valor de 109.5° como en el metano, a pesar de que el amoníaco tiene hibridación \mathrm{sp}^{3} .
La razón. Recuerda la teoría: los pares de electrones no enlazados presentes en una molécula modifican ligeramente los ángulos de enlace porque ocupan más espacio. Lo que quiere decir que, en el \mathrm{NH}_{3} los enlaces H―N están comprimidos y tienen un valor de 107.3°
Tip: domina la formación de enlaces
- Familiarízate con la valencia de los elementos, ya que corresponde al número de enlaces que los átomos, por lo general, forman


