¡Bienvenido aspirante! Resolvamos paso a paso los 10 reactivos de química comprendidos desde 21 al 30 que pertenecen a la guía de estudio UNAM, área 4 de humanidades y artes.

¿Cómo estudiar de la guía? El material que colocamos a tu disposición es una herramienta con reactivos semejantes a los del examen real. Tiene la solución para que resuelvas previamente el enunciado y luego confirmes si la opción que elegiste es correcta.
Adicional a los temas académicos, consideramos que para dominar la prueba real debes estar enterado de todos sus detalles. Razón por la que te explicamos la estructura del examen. Inicia leyendo sus generalidades:
- Desarrollo: UNAM
- Área 4: Humanidades y artes
- Materia: Química
- Reactivos: 120
- Tipo: Opción múltiple
- Duración: 3 horas
- Modalidades: Presencial
Estructura del examen
El área de humanidades y artes comprende 39 licenciaturas de las 132 carreras ofertadas por la UNAM.
Cinematografía es una carrera de área 4 que pertenece a una de las 26 carreras de ingreso indirecto ofertadas en la UNAM. Para ingresar a ella necesitas cumplir con una serie de requisitos extras a los que requiere el examen de ingreso.
El examen cuenta con 120 reactivos divididos en 9 materias diferentes, generalmente. Pero, área 4 posee filosofía como asignatura adicional; por lo que los 120 reactivos se distribuyen entre 10 temas.
Estructura examen área 4
| Temas | Reactivos |
| Español | 18 |
| Matemáticas | 22 |
| Física | 10 |
| Química | 10 |
| Biología | 10 |
| Historia universal | 10 |
| Historia de México | 10 |
| Literatura | 10 |
| Geografía | 10 |
| Filosofía | 10 |
| Total | 120 |
Aunque el enfoque de humanidades y artes es la filosofía, es indispensable responder correctamente el módulo de química porque juega un papel importante en la totalidad de aciertos necesarios para ingresar a la universidad.
Temario de química área 4
¿Qué temas de química necesito estudiar? Conoce el temario completo de química que necesitas aprender para aprobar tu examen de admisión UNAM área 4.
- Temas básicos
- Sustancias químicas
- Sustancias puras: elemento y compuesto
- Mezclas: homogéneas y heterogéneas
- Estructura atómica
- Conceptos de átomo, protón, electrón, neutrón, número atómico y masa atómica
- Tabla periódica
- Clasificación de elementos: metales, no metales y metaloides
- Regla del octeto de Lewis
- Propiedades periódicas
- Electronegatividad y tipos de enlace: iónico y covalente
- Clasificación de los compuestos en óxidos básicos, óxidos ácidos (anhídridos), ácidos, bases y sales
- Mol
- Concepto
- Cálculo de masa molar
- Sustancias químicas
- Agua
- Composición del agua y estructura molecular
- Polaridad y puentes de hidrógeno
- Propiedades físicas: puntos de ebullición y de fusión, capacidad calorífica específica
- Propiedades químicas: tipo de enlace, capacidad (poder) disolvente del agua
- Ácidos y bases
- Clasificación por su conductividad: fuertes y débiles
- Diferenciación de las sustancias de acuerdo con su pH
- Indicadores y pH
- Soluciones o disoluciones
- Concepto de soluto y disolvente
- Contaminación del agua
- Principales contaminantes: físicos, químicos y biológicos
- Fuentes generadoras: industrial, urbana y agrícola
- Importancia y aplicaciones del agua para la humanidad
- Uso responsable y preservación del agua
- Composición del agua y estructura molecular
- Aire
- ¿Qué es el aire?
- Composición porcentual del aire
- Reacciones del oxígeno
- Reacciones de combustión
- Formación de óxidos básicos
- Formación de óxidos ácidos (nitrógeno, azufre y carbono)
- Reacciones de óxido-reducción
- Ciclos del oxígeno, nitrógeno y carbono
- Contaminantes del aire
- Contaminantes primarios del aire (óxidos de nitrógeno, carbono y azufre, partículas suspendidas e hidrocarburos
- Principales fuentes generadoras (industriales, urbanas y agrícolas)
- Impacto ambiental: inversión térmica y lluvia ácida
- Alimentos
- Carbohidratos
- Estructura
- Fuente de energía de disponibilidad inmediata
- Lípidos
- Estructura
- Almacén de energía
- Proteínas
- Grupos funcionales presentes en aminoácidos
- Enlace peptídico
- Vitaminas y minerales: fuentes e importancia
- Carbohidratos
- La energía y las reacciones químicas
- Reacciones químicas endotérmicas y exotérmicas
Consejos para estudiar química con efectividad
El módulo de química suele ser uno de los más complejos para estudiar si estás aplicando a una carrera de área 4. La razón es que las carreras de humanidades y artes no tienen bases establecidas en la química como, por ejemplo, las carreras de ciencias biológicas, químicas y de la salud.
Apoyáte en los siguientes consejos para optimizar tu aprendizaje:
- Elementos y compuestos son puntos que siempre vienen en el examen. Pertenecen a los temas básicos de la química y es importante que los estudies a detalle.
- Conocer la composición del agua, polaridad, tensión superficial y puentes de hidrógeno te será de gran ayuda. Al momento de estudiar dibuja la estructura del agua y cómo se enlaza con otras moléculas. Así puedes recordar con mayor facilidad toda la información.
- Resuelve ejercicios, además de conocer la teoría debes practicar constantemente cada tema.
- Analiza la tabla periódica, de ahora en adelante la tabla periódica es tu mejor amiga para entender el comportamiento de muchos elementos, a qué grupo pertenecen, números de oxidación y más.
- ¡Planifícate! Tomar cada uno de los puntos del temario y distribuirlos en un horario que se ajuste a tu semana para no perder el enfoque de formación.
Guía química UNAM área 4 resuelta
Iniciamos la guía de estudio resuelta de los 10 reactivos de química para el área de humanidades y artes de la UNAM.
Reactivo 21
De las siguientes combinaciones, el ________ es un compuesto y el ________ es un elemento.
- Platino – azúcar
- Azúcar – acero
- Acero – azúcar
- Azúcar – platino
Solución:
El azúcar que utilizamos para endulzar los alimentos es conocida como sacarosa, un disacárido formado por glucosa y fructosa. Su fórmula condensada es {C}_{12}{H}_{22}{O}_{11} . Es un compuesto formado por carbono, oxígeno e hidrógeno. Por otro lado, el platino es un elemento metálico.
En este sentido, podemos deducir que de las siguientes combinaciones, el azúcar es un compuesto y el platino es un elemento.
Respuesta correcta opción D.
Reactivo 22
Una medalla de bronce es un ejemplo de:
- Mezcla heterogénea
- Mezcla homogénea
- Compuesto
- Elemento
Solución:
Una mezcla se forma por la unión de dos o más sustancias en diversas proporciones. La mezcla formada presenta características propias diferentes a la de sus componentes; estas características varían según las proporciones en que se encuentren las sustancias que la forman.
Si los componentes de una mezcla no se pueden diferenciar a simple vista o usando un microscopio, se dice que la mezcla es homogénea. Sin embargo, si sus componentes se pueden distinguir, se habla de que la mezcla es heterogénea.
Al observar una medalla de bronce, no podemos diferenciar en ella diferentes fases de una mezcla, por lo que corresponde a una mezcla homogénea. Se cree que las medallas están fabricadas solo con el elemento que tienen por nombre, pero, por ejemplo, la medalla de bronce tiene un 97% de cobre, el resto es zinc y estaño. La medalla de oro solo posee 1.34% de dicho metal y la de planta contiene aproximadamente 92.5% de su elemento.
La respuesta correcta es la opción B.
Reactivo 23
¿Qué familia de elementos de la tabla periódica es menos reactiva?
- Metales alcalinos.
- Halógenos.
- Gases nobles.
- Metales alcalinotérreos.
Solución:
Los gases nobles son la familia de elementos menos reactiva, ya que sus átomos tienen los subniveles externos ns y np llenos por completo, lo que les otorga una gran estabilidad. Por ejemplo, el helio es 1{s}^{2} .
Las energías de ionización de los elementos del grupo de los gases nobles (VIIIA) se encuentran entre las más altas de todos los elementos y no tienden a aceptar más electrones.
La respuesta correcta es la opción C.
Reactivo 24
Época en la que se avanza más el conocimiento de la estructura atómica.
- Segunda mitad del siglo XIX.
- Primera mitad del siglo XX.
- Primeros años del siglo XXI.
- Segunda mitad del siglo XX.
Solución:
En la primera mitad del siglo XX es la época en la que más se avanza sobre el conocimiento de la estructura atómica. Grandes mentes como Rutherford, Bohr, Broglie, Curie, Schrödinger entre otros, contribuyeron a comprender y desarrollar la estructura de los átomos.
La respuesta correcta es la opción B.
Reactivo 25
Si se tiene HCl concentrado al 37% masa–masa ¿Qué cantidad se necesita para preparar 250 ml 1.4 M en disolución acuosa?
Considera: d = 1.14 g/mL
- 34 ml
- 30 ml
- 14 ml
- 12 ml
Solución:
El problema solicita calcular la cantidad de solución concentrada al 37% m/m HCl que necesito para preparar 250 ml de una solución a 1.4 M. El enunciado no especifica en qué unidad se debe expresar la cantidad de solución de HCl que se debe agregar, pero observando los incisos podemos determinar que se debe formular en ml.
Por lo tanto, el objetivo del problema es calcular los ml que se deben tomar de la solución al 37% m/m para preparar la segunda solución. Comencemos por calcular los g de soluto que se deben agregar en la solución final para obtener los 1.4 M en 250 ml.
Ecuación de molaridad:
M=\frac{n de moles}{V \left(L\right)}
Despejamos el n de moles de la expresión anterior:
n moles=M \bullet V
Sustituimos los valores:
n moles=1.4 M \bullet 0.25 L=0.35 moles
(El volumen de la solución se debe expresar en L, por ello se ha transformado los 250 ml a 0.25 L)
Ahora debemos calcular los g del soluto, para ello debemos conocer el peso molecular de HCl
- H: 1 \bullet 1=1
- Cl: 35.5 \bullet 1=35.5
PM HCl=35.5+1=36.5 g/mol
La ecuación para conocer el n de moles es n moles=\frac{m}{PM}
Despejamos m :
m=n moles \bullet PM
m=0.35 mol \bullet 36.5\frac{g}{mol}=12.77 g
Gramos de soluto que debe tener la solución final: 12.77 g
Debido a que la concentración del %m/m de la primera solución es: masa del soluto/masa de la solución, conociendo los g de soluto que debe tener la solución final, despejamos de la ecuación de concentración m/m los gramos de solución que se deben tomar.
\%\frac{m}{m}=\frac{g soluto}{g solución} \bullet 100
Despejamos g de solución:
g sol=\frac{g soluto}{\%\frac{m}{m}} \bullet 100
Sustituimos los valores:
g sol=\frac{12.77}{37} \bullet 100=34.51 g
Finalmente, transformamos los g de solución a volumen, utilizando la densidad dada por el enunciado:
\rho =\frac{m}{v}\to v=\frac{m}{\rho }
v=\frac{34.51 g}{1.14\frac{g}{ml}}=30.2 ml
Aproximamos el resultado a v=30 \mathrm{m}\mathrm{l} .
La respuesta correcta es la opción B.
Reactivo 26
Propiedad del agua gracias a la cual un insecto puede caminar sobre ella.
- Densidad.
- Tensión superficial.
- Polaridad de la molécula.
- Formación de puentes de hidrógeno.
Solución:
Las moléculas que se encuentran en el seno de un líquido son atraídas en todas direcciones por las fuerzas intermoleculares; no hay tendencia hacia una dirección única.
Sin embargo, las moléculas de la superficie son atraídas hacia abajo y hacia los lados por otras moléculas, pero no hacia arriba de la superficie. En consecuencia, estas atracciones intermoleculares tienden a atraer esas moléculas hacia el líquido, lo que ocasiona que la superficie se tense como si fuera una película elástica.
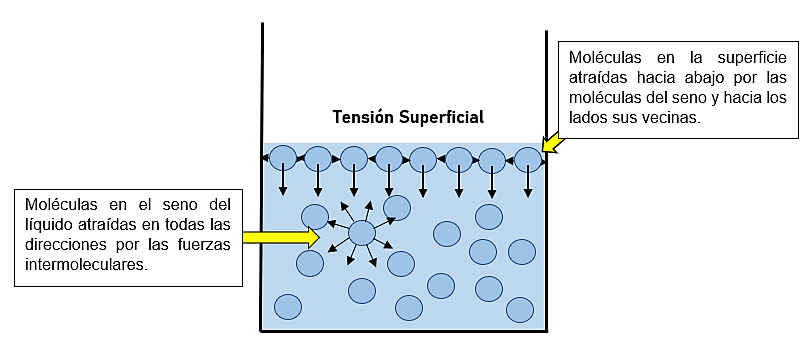
Dicha fuerza de atracción es lo que permite que las hojas se queden sobre el agua, que los mosquitos caminen sobre ella e incluso es lo que le da la forma a la gota, ya que la tensión superficial busca reducir el área superficial del líquido.
La respuesta correcta es la opción B.
Reactivo 27
¿Cuál de los siguientes valores de pH corresponde a la mayor concentración de iones OH?
- 2
- 7
- 8
- 13
Solución:
Una mayor concentración de iones OH corresponde a un pH alcalino. En este sentido, podemos deducir que el mayor valor de alcalinidad por concentración de iones OH es el pH = 13.
La respuesta correcta es la opción D.
Reactivo 28
Para que se lleve a cabo una reacción de combustión es necesario
- Un combustible y energía.
- Oxígeno y energía.
- Un combustible y un comburente.
- Oxígeno y un comburente.
Solución:
Para que se lleve a cabo una reacción de combustión es necesario un elemento que libere energía al oxidarse cuando se combina con un comburente, el comburente por excelencia es el oxígeno del aire (agente oxidante).
La respuesta correcta es la opción C.
Reactivo 29
El enlace peptídico se forma al reaccionar un grupo amino de un aminoácido con un grupo ________ de otro aminoácido.
- –OH
- –OR
- –COOH
- –CHO
Solución:
El enlace peptídico se forma al reaccionar un grupo amino de un aminoácido con un grupo carboxilo (–COOH) de otro aminoácido.
La respuesta correcta es la opción C.
Reactivo 30
Las reacciones de combustión son _________ porque _________ energía calorífica hacia los alrededores.
- Exotérmicas – liberan
- Exotérmicas – absorben
- Endotérmicas – liberan
- Endotérmicas – absorben
Solución:
En todas las reacciones químicas se manifiestan cambios de energía que puede ser absorbida o liberada en forma de calor, luz, electricidad y/o mecánica. Cuando una reacción libera energía en forma de calor o energía térmica al entorno, se dice que la reacción es exotérmica; y cuando la energía es extraída del entorno para que se efectúe, la reacción es endotérmica.
Una reacción química exotérmica tiene las siguientes características:
- Libera calor
- La energía de los reactivos es mayor que la de los productos
- La energía se desprende conforme se forman los productos
- El calor fluye hacia afuera del sistema
En dicho sentido, las reacciones de combustión son exotérmicas porque liberan energía calorífica hacia los alrededores. La respuesta correcta es la opción A.


