En este tutorial te ayudaremos con la Guía resuelta del IPN en el área de Química. Nos interesa que estés preparado al 100% de cara a tu examen de admisión al IPN, por este motivo, preparamos esta serie de post dividida en 3 partes, donde resolvemos los 35 reactivos de la guía de Química para el área de Ingeniería y Ciencias Físico Matemáticas.

Ten en cuenta que la estructura del examen de ingreso al IPN en la parte de química comprende un total de 15 preguntas. No olvides que al presentar esta prueba, deberás resolver un total de 130 preguntas, las cuales se distribuyen a través de diferentes áreas de conocimiento.
Recuerda que la clave del éxito para lograr un buen puntaje, es prepararte para cada una de las partes de este examen. ¡Empieza a prepararte y asegura tu lugar como estudiante del IPN!
¿Qué viene en el examen del IPN?
El examen de admisión del Instituto Politécnico Nacional comprende el abordaje de dos etapas distintas. La primera de ellas va orientada a la resolución de problemas matemáticos y de lengua, mientras que la segunda, se enfoca en campos concretos como la química, física y biología.
En vista de esto, acá te mostramos cuál es la composición de reactivos que estructuran este examen:
- 50 preguntas de matemáticas.
- 40 preguntas de comunicación.
- 10 preguntas de biología.
- 15 preguntas de química.
- 15 preguntas de física.
Dicho esto, a continuación empezamos con la primera parte de nuestra guía resuelta de reactivos de química:
Ejercicio 1: Orbitales moleculares
En el \mathrm{NH}_{3} ¿Cuál es la hibridación del nitrógeno?
- sp
- \mathrm{sp}^{2}
- \mathrm{sp}^{3}
- \mathrm{sp}^{3}\mathrm{d}
Solución:
Para la resolución del ejercicio se debe comprender que el orbital molecular de enlace es una zona del de alta densidad electrónica, ya que es en ese lugar en donde interactúan las cargas de los átomos que están formando una unión.
La hibridación del átomo de nitrógeno en el amoníaco depende del número de enlaces sencillos más la presencia de los pares de electrones no enlazados.
El nitrógeno sólo puede compartir tres pares de electrones y necesita mantener un par de electrones no enlazados para que la molécula formada sea estable. Por lo tanto la estructura de Lewis sería la siguiente:

- Como puedes observar hay tres enlaces sencillos y un par de electrones no enlazados
- Por lo tanto, se necesitan cuatro orbitales híbridos. Lo que significa una hibridación s p^{3}
Comparado con las opciones que ofrece el problema, la opción correcta es la C.
Ejercicio 2: Estado de la materia
Los metales son sustancias que se encuentran en estado ________ y tienen ________ fijos debido a la fuerza de atracción entre sus moléculas.
- Sólido – forma y color
- Sólido – volumen y forma
- Gaseoso – volumen y masa
- Gaseoso – forma y volumen
Solución:
Los metales son elementos sólidos a temperatura ambiente, con excepción del mercurio (Hg) el cual es el único metal líquido. Las moléculas de los sólidos se mantienen juntas de forma ordenada y con una libertad de movimiento casi nula gracias a las fuerzas intermoleculares que lo conforman. En resumen, los materiales sólidos tienen forma y volumen propios.
Gracias al análisis realizado se puede establecer que la opción correcta es la B.
[wpipa id=»6649″]Ejercicio 3: Características físicas de los compuestos
Relacionar las sustancias con las características física que le corresponda:

- 1A, 2B, 3D, 4C
- 1A, 2D, 3C, 4B
- 1D, 2C, 3A, 4B
- 1D, 2A, 3B, 4C
Solución:
Las propiedades macroscópicas de los compuestos son aquellas que pueden determinarse a simple vista. Para establecer la relación entre ambas columnas se puede iniciar con un análisis preciso de los elementos presentes entre las sustancias:
- Vino: es una mezcla con criterio óptico homogéneo porque las partículas que lo componen no se diferencian unas de otras a simple vista. Relación: 1D
- El magnesio: es un elemento metálico de gran importancia para la realización de procesos metabólicos en el organismo, entre otras funciones, es un elemento puro formado por un solo tipo de átomos. Relación: 2C
- El cloruro de sodio está presente en las verduras encurtidas principalmente para mantenerlas a lo largo del tiempo, además de brindarle sabor. Relación 3A
- Las verduras encurtidas son comestibles en los que los diversos componentes se diferencian unos de otros a simple vista. Relación: 4B
En base al análisis realizado se puede concluir que la respuesta correcta es la opción C
Ejercicio 4: Subniveles de energía
El número máximo de los electrones en el subnivel d es:
- 2
- 6
- 10
- 14
Solución:
Los subniveles de energía s, p, d, f compuestos por orbitales atómicos, definen la distribución de la densidad electrónica de un elemento, estableciendo un número máximo específico de electrones en cada subnivel, los cuales son los siguientes:
- s = 2
- p = 6
- d =10
- f = 14
La respuesta correcta del ejercicio es la opción C.
Ejercicio 5: Compuestos químicos
Ordena los anhídridos de forma descendente de acuerdo con el número de oxidación del no metal.
- \mathrm{Cl}_{2} \mathrm{O}
- \mathrm{Cl}_{2} \mathrm{O}_{3}
- \mathrm{Cl}_{2} \mathrm{O}_{7}
- \mathrm{Cl}_{2} \mathrm{O}_{5}
Opciones:
- 1, 2, 3, 4
- 3, 2, 4, 1
- 3, 4, 2, 1
- 1, 4, 2, 3
Solución:
El cloro y el oxígeno pertenecen al grupo de los no metales. Sin embargo, el oxígeno tiene la capacidad de alterar el comportamiento del elemento al que se encuentra enlazado debido al elevado poder de atracción que muestra hacia los electrones.
En este sentido, a pesar de que los no metales presentan la tendencia natural de ganar electrones, no pueden resistirse a la fuerza del oxígeno y en este caso ceden los electrones. Es por ello que, en compuestos de esta rama, los elementos no metálicos trabajan números de oxidación positivos cuando se combinan con el oxígeno.
Los números de oxidación para el Cl son los siguientes: -1, +1, +3, +5, +7. Siendo el mayor valor +7 y el menor +1.
Recuerda que cuando dos elementos se combinan, en la fórmula química se observa el intercambio de los números de oxidación, es decir:
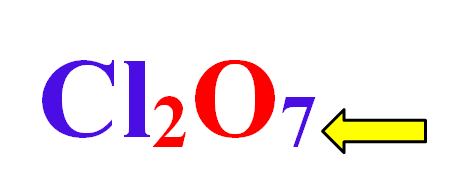
Para evaluar el número de oxidación del cloro debes tener en cuenta el número que se encuentra junto al oxígeno.
Como el problema te dice que ordenes de mayor a menor (orden descendente) los compuestos según el número de oxidación del no metal. El resultado sería el siguiente:
3. \mathrm{Cl}_{2} \mathrm{O}_{7}
4. \mathrm{Cl}_{2} \mathrm{O}_{5}
2. \mathrm{Cl}_{2} \mathrm{O}_{3}
1. \mathrm{Cl}_{2} \mathrm{O}
La opción correcta para el ejercicio 5 es la C
Ejercicio 6: Peso Molecular
Ordena de manera ascendente las siguientes sustancias de acuerdo a su peso molecular:
(Masas atómicas: Na: 23 g/mol, C: 12 g/mol, O: 16 g/mol, H: 1 g/mol, Al: 27 g/mol, N: 14 g/mol, S: 32 g/mol)
- \mathrm{SO}_{3}
- \mathrm{Al}_{2} \mathrm{O}_{3}
- \mathrm{H}_{2} \mathrm{CO}_{3}
- \mathrm{NaNO}_{3}
- 4, 3, 1 ,2
- 4, 2, 3, 1
- 3, 2, 4, 1
- 3, 1, 4, 2
Solución:
Una molécula es la suma de dos o más átomos, con propiedades químicas específicas. Para calcular el peso molecular de un compuesto se necesita conocer:
- Masa o peso atómico de cada elemento presente
- Número de átomos de cada elemento presente en el compuesto (representado por el número en el subíndice junto a cada elemento de la molécula)
- Luego se multiplica el número de átomos del elemento por su respectivo peso atómico
- Y para obtener el peso molecular de la molécula completa se suman los resultados de las multiplicaciones realizadas para cada elemento del compuesto
La elaboración de una tabla similar te facilitará los cálculos de cada peso molecular:
Para el \mathrm{SO}_{3} :
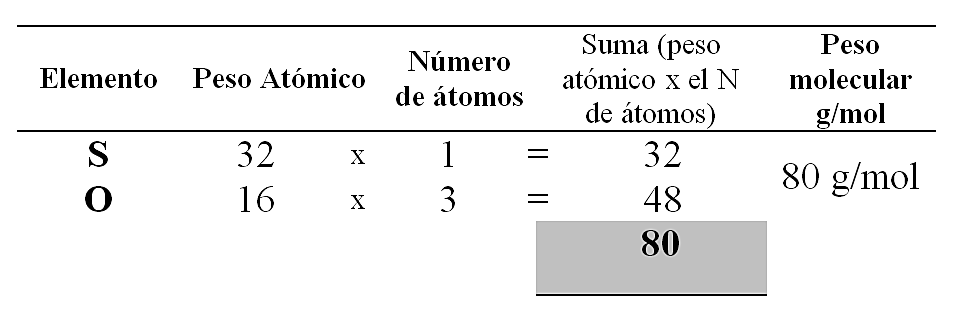
Para el \mathrm{Al}_{2} \mathrm{O}_{3} :

Para el \mathrm{H}_{2} \mathrm{CO}_{3} :
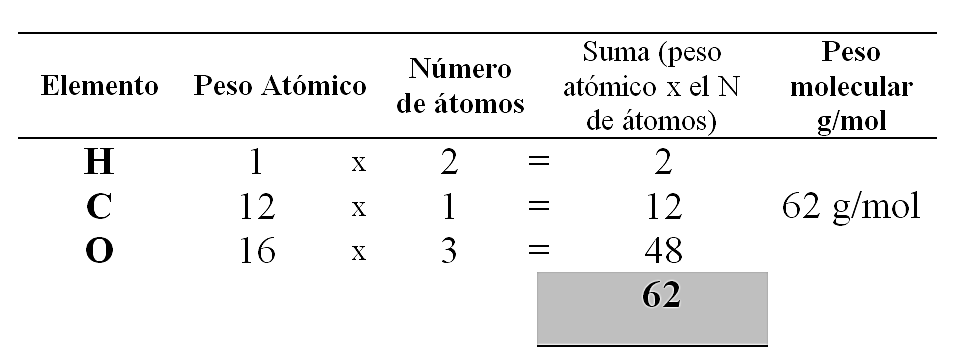
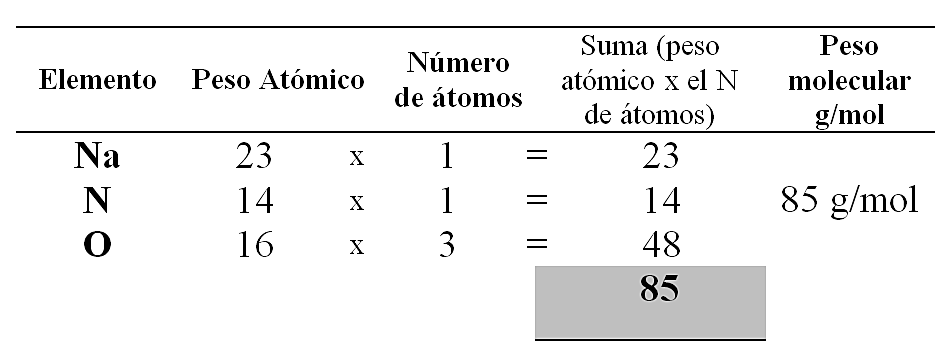
Para el \mathrm{NaNO}_{3} :
Cada peso molecular quedaría ordenado de forma ascendente de la siguiente manera:
3. \mathrm{H}_{2} \mathrm{CO}_{3}
1. \mathrm{SO}_{3}
4. \mathrm{NaNO}_{3}
2. \mathrm{Al}_{2} \mathrm{O}_{3}
La opción correcta es la D
Ejercicio 7: Soluciones
Relacionar el tipo de concentración de soluciones con sus respectivas unidades:

- 1A, 2D, 3B, 4C
- 1D, 2A, 3B, 4C
- 1A, 2B, 3C, 4D
- 1D, 2C, 3B, 4A
Solución:
Analizamos la columna de la concentración:
- El porcentual masa/volumen expresa la masa en gramos del soluto disuelta en 100 ml de solución
- La molaridad se representa con la letra “M” se refiere a los moles de soluto disueltos en cada litro de solución
- La molalidad hace referencia al número de moles de soluto disueltos en un Kg de disolución. Se representa con la letra “m”
- Normal: Es una unidad de concentración que expresa el número de equivalentes de soluto que se encuentra disuelto en un litro de solución
Ahora relacionamos las concentraciones con sus unidades respectivas:

La opción correcta es la D.
Ejercicio 8: Reacciones de óxido-reducción
En la reacción: \mathrm{AgNO}_{3}+\mathrm{Pb} \rightarrow \mathrm{Pb}\left(\mathrm{NO}_{3}\right)_{2}+\mathrm{Ag} ¿Qué elemento se reduce?
- N
- O
- Ag
- Pb
Solución:
Para resolver el ejercicio es importante tener presentes algunas consideraciones como:
- Oxidación: \uparrow Aumento del número de oxidación \uparrow pérdida de electrones
- Reducción: \downarrow Disminución del número de oxidación \downarrow ganancia de electrones
Analizamos:
Paso 1: Identificar los números de oxidación con los que trabaja cada compuesto antes y después de la reacción:
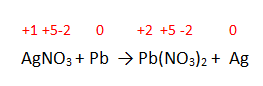
Paso 2: En el comportamiento de los elementos la plata del compuesto nitrato de plata tiene un número de oxidación mayor antes de la reacción. En el producto el elemento se ha reducido perdiendo electrones. Por lo tanto, el elemento que se reduce es la plata (Ag).
La opción correcta es la C.
Ejercicio 9: Reacciones químicas
Es la ecuación química que representa una reacción de análisis:
- \mathrm{H}_{2} \mathrm{O} \rightarrow \mathrm{H}_{2}+\mathrm{O}_{2}
- \mathrm{Na}+\mathrm{Cl}_{2} \rightarrow \mathrm{NaCl}
- \mathrm{Zn}+\mathrm{HBr} \rightarrow \mathrm{ZnBr}_{2}+\mathrm{H}_{2}
- \mathrm{AgNO}_{3}+\mathrm{HCl} \rightarrow \mathrm{AgCl}+\mathrm{HNO}_{3}
Solución:
Las reacciones de análisis también llamadas de descomposición, son todas aquellas reacciones químicas en las que hay una ruptura de enlaces o separación de los componentes de una especie química.
Con esto en mente se evalúan cada una de las opciones y se puede observar que la única reacción química en la que hay una ruptura de enlaces es \mathrm{H}_{2} \mathrm{O} \rightarrow \mathrm{H}_{2}+\mathrm{O}_{2} El agua se separa en sus elementos fundamentales: hidrógeno y oxígeno.
La opción correcta es la A.
Ejercicio 10: Reacciones químicas
¿Cuál es el producto de la reacción de sodio con nitrógeno?
- \mathrm{NaN}_{1}
- \mathrm{Na}_{2} \mathrm{~N}
- \mathrm{NaN}_{2}
- \mathrm{Na}_{3} \mathrm{~N}
Solución:
- Como el problema habla de la reacción entre el sodio y el nitrógeno, nos damos cuenta que es una sal
- El sodio tiene valencia +1
- El nitrógeno trabaja con la valencia -3 (porque es la que utiliza junto al H)
- Recuerda que las valencias se intercambian
Formulación:
N a^{+1}+N^{-3} \rightarrow N a_{3} N
La respuesta correcta es la opción D.
Ejercicio 11: Reacciones de óxido-reducción
En la siguiente reacción ¿Qué sustancia es el agente oxidante? \mathrm{PbO}+\mathrm{CO} \rightarrow \mathrm{Pb}+\mathrm{CO}_{2}
- Pb
- CO
- \mathrm{CO}_{2}
- PbO
Solución:
Para conocer el agente oxidante o el agente reductor es imprescindible tener en mente las siguientes condiciones:
Agente oxidante: Es el reactante que tiene el elemento que se reduce
Agente reductor: Reactante que tiene el elemento que se oxida
Paso 1: Analizar el comportamiento de los números de oxidación de cada elemento que participa en la reacción
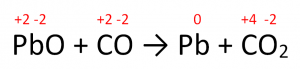
Paso 2: El agente oxidante es el reactante que posee el elemento que se reduce. Por lo tanto, identificamos que el Pb es el elemento que se reduce, gana electrones y su número de oxidación disminuye. El agente oxidante es el compuesto PbO, ya que es EL REACTANTE que tiene el elemento que se reduce.
Otra forma de comprender la reacción es que el PbO es el agente oxidante porque tiene el elemento que va a recibir los electrones del elemento que los pierde, haciendo que este último se oxide.
La opción correcta es la D.
[wpipa id=»6866″]Ejercicio 12: Reacciones químicas
En las ecuaciones químicas podemos encontrar información de las propiedades físicas y químicas de los compuestos que intervienen en ellas, por medio de signos auxiliares ¿Qué representan los signos \uparrow \text{ y } \Delta respectivamente?
- Calor – sólido que precipita
- Sólido que precipita – calor
- Calor – gas que se desprende
- Gas que se desprende – calor
Solución:
Las ecuaciones químicas brindan información importante acerca de lo que sucede cuando dos elementos reaccionan entre sí. La simbología es una guía importante para analizar y establecer las condiciones de la reacción. Es por ello que en química el signo \uparrow hace referencia a un gas que se desprende y \Delta representa calor.
La opción correcta es la D.


