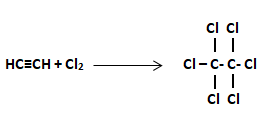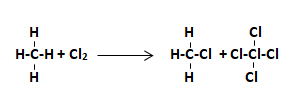En este tutorial resolvemos la parte 2 de la guía del IPN correspondiente al área de química para Ingeniería y Cs Físico-Matemáticas. Un aspecto clave que debes considerar si estás interesado en estudiar cualquier carrera del área de Ingeniería y Ciencias Físico Matemáticas del Instituto Politécnico Nacional, es que deberás presentar un examen de admisión compuesto de reactivos de diferentes campos de conocimiento.

No dejes pasar tu oportunidad y logra el puntaje requerido para ser admitido en el IPN. Recuerda que en función de tu puntaje, tendrás la posibilidad de ser admitido en la carrera que deseas. Por ello, ten presente que el examen de admisión se compone de 130 preguntas, ¡Empieza a prepararte desde ya!
¿Qué viene en el examen del IPN?
El Instituto Politécnico Nacional plantea su examen de admisión en dos partes diferentes. La primera de ellas se enfoca en campos generales como la lengua y las matemáticas. Luego, la segunda de ellas aborda campos de conocimiento más concretos como la Física, la Biología y la Química.
Con respecto a la distribución de preguntas de este examen, a continuación te mostramos qué cantidad de reactivos encontrarás de cada área:
- 50 preguntas de matemáticas.
- 40 preguntas de comunicación.
- 10 preguntas de biología.
- 15 preguntas de química.
- 15 preguntas de física.
Sin más que añadir, te dejamos con la segunda parte de nuestra guía resuelta de reactivos de química:
Ejercicio 13: Nomenclatura de compuestos orgánicos
Relaciona el nombre del compuesto con su fórmula molecular:

- 1A, 2B, 3C, AD
- 1C, 2B, 3D, 4A
- 1C, 2A, 3D, 4B
- 1A, 2D, 3B, 4C
Solución:
Cada uno de los nombres presentes en la primera columna hace referencia a hidrocarburos saturados o alcanos. Y todos se encuentran acompañados de radicales alquílicos en mayor o menor proporción según lo indica la numeración.
La relación sería la siguiente:

Entre las opciones del ejercicio la respuesta correcta es la C.
Ejercicio 14: Grupos funcionales
Relaciona el nombre con el grupo funcional y selecciona la respuesta correcta:

- 1C, 2E, 3A, 4D, 5B
- 1D, 2B, 3C, 4A, 5E
- 1D, 2C, 3B, 4E, 5A
- 1C, 2E, 3A, 4B, 5D
Solución:
- El éster tiene un oxígeno adicional unido al grupo carbonilo. Por lo tanto, identifica las opciones en la columna B que tienen el grupo carbonilo con un oxígeno extra. El cuál sería la opción D. (1D)
- La amina tiene la particularidad de poseer átomos de nitrógeno en su estructura. En la columna B la opción C es la única con un átomo de nitrógeno. (2C)
- Los halogenuros de alquilo son aquellos que tienen un carbono unido a un elemento más electronegativo, un halógeno (-X). (3B)
- Los alcoholes son compuestos carbonados que tienen en su estructura al grupo hidroxilo (-OH). En la columna de grupos funcionales la opción E se adapta a esta definición. (4E)
- Por último, las sales orgánicas derivadas de los ácidos carboxílicos han sustituido el H del grupo COOH por un metal que por lo general es Na o K. Con una formulación así: -COOM. (5A)
En resumen la respuesta se constituye por: 1D, 2C, 3B, 4E, 5A siendo la letra C la opción correcta para este ejercicio.
Ejercicio 15: Reacción de neutralización
Para neutralizar la sustancia activa de hidróxido de amonio, de un producto empleado para la limpieza de superficies del hogar, se emplea ácido clorhídrico ¿Cuál es la reacción que ejemplifica este proceso?
- \mathrm{NH}_{4}+\mathrm{HCl} \rightarrow \mathrm{NH}_{3}+\mathrm{Cl}_{2}
- \mathrm{NH}_{3}+\mathrm{H}_{2} \mathrm{Cl} \rightarrow \mathrm{NH}_{4} \mathrm{Cl}+\mathrm{Cl}_{2}
- \mathrm{NH}_{4} \mathrm{OH}+\mathrm{HCl} \rightarrow \mathrm{NH}_{4} \mathrm{Cl}+\mathrm{H}_{2} \mathrm{O}
- \mathrm{NH}_{2} \mathrm{OH}+\mathrm{HClO} \rightarrow \mathrm{NH}_{3} \mathrm{Cl}+\mathrm{H}_{2} \mathrm{O}
Solución:
Paso 1: Identifica la fórmula empírica de los compuestos que te mencionan en el problema.
Hidróxido de amonio: \mathrm{NH}_{4} \mathrm{OH}
Ácido clorhídrico: \mathrm{HCl}
Paso 2: Reconoce la reacción que posee el \mathrm{NH}_{4} \mathrm{OH} y el \mathrm{HCl} entre las opciones del problema.
La única reacción que posee los compuestos señalados es la siguiente:
\mathrm{NH}_{4} \mathrm{OH}+\mathrm{HCl} \rightarrow \mathrm{NH}_{4} \mathrm{Cl}+\mathrm{H}_{2} \mathrm{O}
Paso 3: Según la teoría, la neutralización ocurre cuando se mezcla un ácido y una base y el producto es una sal más agua. Se debe verificar que la reacción química ocurre entre una base y un ácido:
\mathrm{NH}_{4} \mathrm{OH}+\mathrm{HCl} \rightarrow \mathrm{NH}_{4} \mathrm{Cl}+\mathrm{H}_{2} \mathrm{O}
\text { Base }+\text { Ácido } \rightarrow \text { Sal }+\text { Agua }
En efecto la reacción es una neutralización. La respuesta correcta es la opción C.
Ejercicio 16: Métodos de separación de mezclas
¿Cuál método se utiliza para separar un sólido de tamaño muy pequeño que se encuentra suspendido en un líquido?
- Centrifugación
- Evaporación
- Decantación
- Destilación
Solución:
La centrifugación: es un método de separación de mezclas que se ejecuta mediante el uso de una máquina centrifugadora que gira a gran velocidad (RPM). Se encarga de separar partículas sólidas muy pequeñas suspendidas en un líquido. Es requerida de forma indispensable en el laboratorio clínico para separar las células sanguíneas (como los leucocitos, eritrocitos y plaquetas) del plasma o suero dentro del laboratorio clínico.
En base a la fundamentación teórica podemos definir que la opción correcta es la A.
Ejercicio 17: Disociación de enlace
La ruptura _______ se presenta cuando se forman_______ al romperse el enlace covalente.
- Homolítica – iones
- Heterolítica – electrófilos
- Homolítica – radicales libres
- Heterolítica – radicales libres
Solución:
La ruptura homolítica (también llamada ruptura en radicales) forma radicales libres, mientras que la ruptura heterolítica (o ruptura iónica) genera iones. Por lo tanto, la opción correcta es la C.
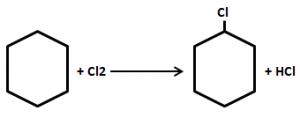
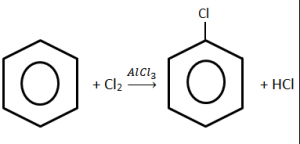
Ejercicio 18: Compuestos Aromáticos
¿Cuál de las siguientes reacciones corresponde a la obtención de un compuesto aromático?
Solución:
La clave para resolver este tipo de ejercicio químico es identificar el compuesto con el anillo del benceno. El hexágono con el anillo central es característico de los compuestos aromáticos. Entre las opciones del ejercicio la única reacción con un compuesto aromático es la B.
La opción correcta es la B.
Ejercicio 19: Enlaces del carbono
Identificar cuántos carbonos terciarios presenta el siguiente hidrocarburo:
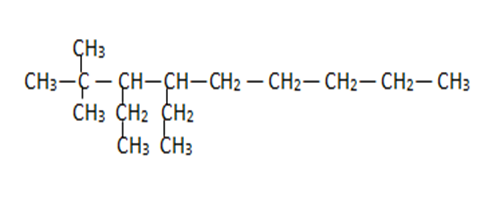
- 5
- 4
- 3
- 2
Solución:
Los enlaces del carbono se pueden clasificar en: primarios, secundarios, terciarios y cuaternarios. La clasificación depende del número de carbonos con los que se encuentra formando un enlace. Un carbono terciario es aquel que se encuentra unido tres átomos de carbono y siempre son intermedios.
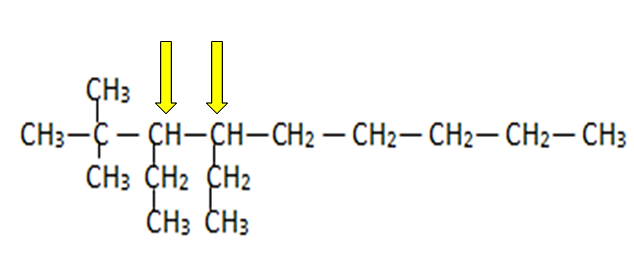
En la estructura del hidrocarburo están presentes 2 carbonos terciarios. La opción correcta es la D.
Ejercicio 20: Descomposición de alcanos
Las moléculas de alcanos se pueden romper por acción del calor en un proceso llamado ______; los enlaces Carbono―Carbono se rompen generando radicales _______ más pequeños
- Pirólisis – alquilo
- Pirólisis – alcanos
- Craqueo – alquinos
- Craqueo – alquenos
Solución:
La pirólisis es la descomposición de una sustancia por acción única del calor. La pirólisis de alcanos en particular se refiere a la combustión de alcanos de cadena larga para romperlos y obtener moléculas más pequeñas. Es una técnica que se utiliza con frecuencia para convertir fracciones con puntos de ebullición más elevados en mezclas de alcanos que pueden combinarse con gasolina.
En asociación a la teoría la opción correcta es la A.
Ejercicio 21: Compuestos orgánicos: alquenos
La hidrogenación de los alquenos permite obtener:
- Alcanos
- Alquinos
- Aldehídos
- Alcoholes
Solución:
La teoría dice que la hidrogenación de alquenos se trata de una reacción de adición, ya que un alqueno en presencia de catalizadores metálicos como el Ni, Pt o P, y a temperatura ambiente, adiciona una molécula de hidrógeno para producir alcanos.
Por lo tanto, la opción correcta es la A.
Ejercicio 22: Compuestos orgánicos: alcanos
La reacción característica de los alcanos es:
- Esterificación
- Halogenación
- Polimerización
- Deshidratación
Solución:
La halogenación de los alcanos es la reacción característica de estos compuestos, la cual se trata de una reacción de sustitución por radicales libre en presencia de luz o calentada a una temperatura de 300°C, los alcanos reaccionan con el cloro o el bromo dando origen a derivados halogenados.
En base a ello la respuesta correcta es la opción B.
Ejercicio 23: Estequiometría
Determinar los valores de los coeficientes: w, x, y \text { y } z respectivamente en la reacción de combustión del metano:
\mathrm{CH}_{4}+\mathrm{O}_{2} \rightarrow \mathrm{CO}_{2}+\mathrm{H}_{2} \mathrm{O}
- 1, 1, 2, 2
- 1, 2, 1, 2
- 2, 3, 1, 2
- 2, 3, 1, 1
Solución:
Paso 1: Verificar el subíndice que acompaña a cada elemento
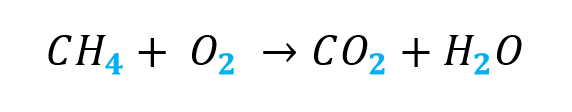
Paso 2: Determina la cantidad de moles que hay de los elementos en el lado de los reactantes y el lado de los productos con el valor del subíndice
\mathrm{CH}_{\mathbf{4}}+\mathrm{O}_{\mathbf{2}} \rightarrow \mathrm{CO}_{\mathbf{2}}+\mathrm{H}_{2} \mathrm{O}
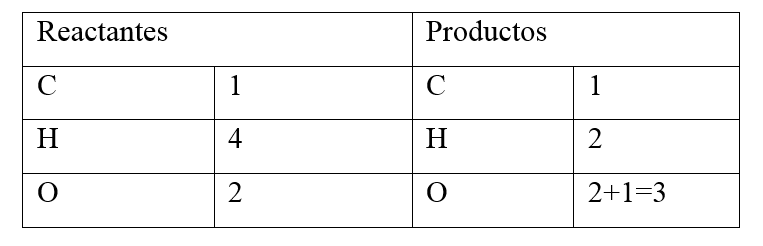
Paso 3: Haz un análisis de la cantidad de moles en los elementos presentes a ambos lados de la ecuación y determina si se encuentra balanceada:
Al verificar los valores: El carbono se encuentra en igual proporción del lado de los productos y del lado de los reactantes, sin embargo no es el mismo caso para los otros elementos.
En el lugar de los reactantes hay 4 moles de hidrógeno mientras que en los productos hay 2 moles. Los moles del oxígeno en el lugar de los reactantes es igual a 2 y en los productos el valor es de 3 (al sumar los 2 moles del \mathrm{O}_{2} del \mathrm{CO}_{2} con el O del agua).
\mathrm{CH}_{\mathbf{4}}+\mathrm{O}_{\mathbf{2}} \rightarrow \mathrm{CO}_{\mathbf{2}}+\mathrm{H}_{\mathbf{2}} \mathrm{O}
En conclusión: La reacción no se encuentra balanceada. El siguiente paso es determinar los coeficientes correspondientes para ello.
Paso 4: Busca números enteros que al multiplicarlos por el subíndice correspondiente igualen el número de moles de un elemento a ambos lados de la reacción.
\mathbf{w} \mathrm{CH}_{\mathbf{4}}+\mathbf{x O}_{\mathbf{2}} \rightarrow \mathbf{y C O}_{\mathbf{2}}+\mathbf{z} \mathrm{H}_{2} \mathrm{O}
\mathbf{1} \mathrm{CH}_{\mathbf{4}}+\mathbf{2} \mathrm{O}_{\mathbf{2}} \rightarrow \mathbf{1} \mathrm{CO}_{2}+\mathbf{2} \mathrm{H}_{2} \mathrm{O}
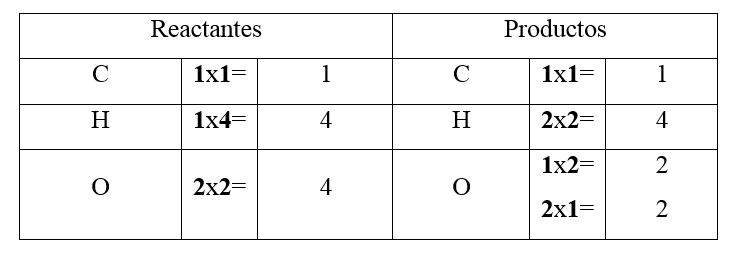
- Moles del C en los reactantes 1 en los productos 1
- Moles del H en los reactantes 4 en los productos 4
- Moles del O en los reactantes 4 en los productos 2+2= 4
La reacción ya está balanceada. Lo que quiere decir que la cantidad relativa de moles de las sustancias que intervienen en la reacción son iguales a ambos lados de la ecuación.
\mathbf{1} \mathrm{CH}_{4}+\mathbf{2} \mathrm{O}_{2} \rightarrow \mathbf{1} \mathrm{CO}_{2}+\mathbf{2} \mathrm{H}_{2} \mathrm{O}
La respuesta correcta es la opción B
Ejercicio 24: Reacciones orgánicas
¿Qué tipo de reacción orgánica representa el siguiente modelo?
\mathrm{CH}_{3} \mathrm{Br}+\mathrm{NaOH} \rightarrow \mathrm{CH}_{3} \mathrm{OH}+\mathrm{NaBr}
- Adición
- Oxidación
- Sustitución
- Eliminación
Solución:
El modelo mostrado representa una reacción de sustitución o desplazamiento, en la que una especie química ataca al sustrato y sustituye a uno de los átomos unidos a un carbono del compuesto.
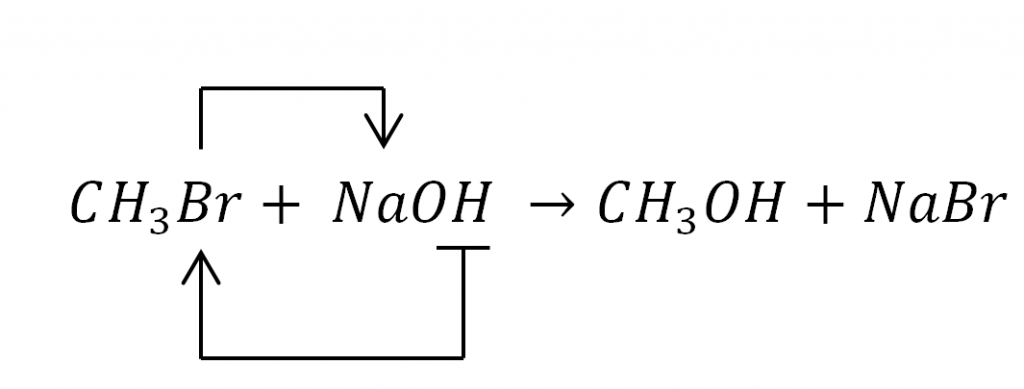
La opción correcta es la C