Continúa tu preparación para el examen de ingreso al poderosísimo IPN resolviendo la segunda y última parte de reactivos de química, rama de las ciencias sociales y administrativas de la guía de estudio IPN 2023.

Comienza leyendo un resumen de la convocatoria IPN 2023:
- Carreras ofertadas en IPN: 70+.
- Porcentaje de Aceptación: 20%.
- Preguntas en el examen de Admisión: 140 preguntas.
- Nuevos temas: Historia e inglés (reading comprehension).
- Tipo: Selección múltiple.
Si es tu primer examen de ingreso, te recomiendo que pongas mucha atención, y comiences a estudiar cuanto antes, ya que el grado de dificultad ha aumentado de nivel.
Temario de Química
La rama de Ciencias sociales y administrativas (CSyA) tiene 4 temas menos que las que comprende CMB e IyCFM como lo ves en la siguiente tabla resumen.
| Tema | Ramas |
|---|---|
| Materia y energía | IyCFM, CMB, CSyA |
| Estructura atómica | IyCFM, CMB, CSyA |
| Elementos de la tabla periódica | IyCFM, CMB, CSyA |
| Enlace químico | IyCFM, CMB, CSyA |
| Nomenclatura química inorgánica | IyCFM, CMB, CSyA |
| Reacciones químicas inorgánicas | IyCFM, CMB, CSyA |
| Reacciones químicas | IyCFM, CMB, CSyA |
| Estequiometría | IyCFM, CMB, CSyA |
| Estructura y nomenclatura de compuestos orgánicos | IyCFM, CMB, CSyA |
| Reacciones químicas de compuestos orgánicos | IyCFM, CMB, CSyA |
| Estado gaseoso | IyCFM, CMB, CSyA |
| Disoluciones | IyCFM, CMB |
| Electroquímica | IyCFM, CMB |
| Termodinámica | IyCFM, CMB |
| Velocidad de reacción y equilibrio químico | IyCFM, CMB |
| Ácidos bases | IyCFM, CMB, CSyA |
Recomendaciones para resolver la guía de estudio IPN 2023
Los siguientes tips te ayudarán a mejorar tu desempeño, en especial para contestar correctamente las preguntas de biología.
- ¡Planifícate! El primer paso para iniciar el compromiso con el estudio. Prepara un horario semanal con los diferentes temas de biología que trae la guía, estudia y al finalizar la jornada autoevalúate resolviendo los reactivos.
- No mires la respuesta correcta. Al leer el enunciado analiza y compara la respuesta indicada con los conocimientos almacenados en tu memoria. Si fallas puedes rectificar y te queda el conocimiento. Y si aciertas a la primera, tus tiempos de respuesta se reducen.
- ¡Aprender cuesta! Es una premisa que debes colocar en una nota y tenerla a la vista. No te frustres cuando algo no te sale a la primera, recuerda que debes establecer las conexiones neuronales para poder recordar cualquier cosa con facilidad, y eso toma tiempo.
- ¡Cronométrate! Establece un tiempo no mayor a 15 minutos por cada 10 reactivos.
- La química se trata de ensayo y error. Por ello, la forma más efectiva de aprender es resolviendo muchos ejercicios de cada tema particular.
- La ley de conservación de la masa y las propiedades de la materia son temas esenciales en el desarrollo de reactivos de química, por ello, estúdialos a fondo.
La estructura de los compuestos químicos es una de las preguntas más repetidas en los reactivos de esta segunda parte. Al resolver la guía con nuestra ayuda tendrás la posibilidad de aumentar tu nivel de retención y reconocimiento de las fórmulas moleculares, empíricas y estructurales.
Reactivo 11
Tomando como referencia los datos de la tabla, determinar la relación mínima de átomos que se requiere para obtener la fórmula empírica del siguiente compuesto:
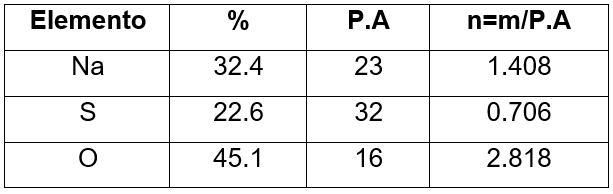
Na___S___O___
- 2, 1, 4
- 2, 4, 1
- 4, 2, 1
- 4, 1, 2
Solución:
Antes de comenzar con la resolución del enunciado, recuerda que los subíndices de la fórmula química representan la cantidad de átomos de ese elemento en el compuesto.
Con esto en mente, para determinar la relación mínima de átomos nos basaremos únicamente en la última columna de la tabla, que representa el número de moles de cada elemento ya que, es la contracción matemática de la siguiente relación:
Si en 1 mol de Na hay 23 g ¿En 32.4 g de Na cuántos moles hay?
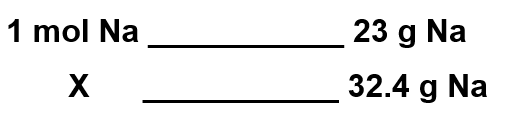
La relación matemática es n=32.4 g Na\times \frac{1 mol Na}{23 g Na}
Un mol representa la cantidad de átomos del elemento (n) por ello se utiliza para determinar la relación mínima de átomos.
En este sentido, llegamos a la fórmula N{a}_{1.4}{S}_{0.7}{O}_{2.8} que brinda la identidad y las relaciones de los átomos presentes, sin embargo, las fórmulas químicas deben ser escritas con números enteros, para obtenerlos dividimos cada cifra entre el menor de los subíndices que es 0.7
Na=\frac{1.4}{0.7}=2
S=\frac{0.7}{0.7}=1
O=\frac{2.8}{0.7}=4
La fórmula empírica del compuesto es:
N{a}_{2}S{O}_{4}
Corresponde al sulfato de sodio. La respuesta correcta es la opción A.
Reactivo 12
Ordenar los siguientes compuestos de forma ascendente de acuerdo con el número de oxidación del bromo:
- HBrO
- HBr{O}_{4}
- HBr{O}_{3}
- HBr{O}_{2}
- 1, 4, 3, 2
- 1, 4, 2, 3
- 2, 3, 4, 1
- 2, 3, 1, 4
Solución:
Para ordenar los compuestos como pide el enunciado debemos asignar el número de oxidación a cada compuesto de la siguiente manera, pero antes recuerda:
- El número de oxidación del hidrógeno siempre es +1 excepto cuando forma hidruros metálicos.
- El número de oxidación del oxígeno siempre es – 2 excepto cuando forma peróxidos.
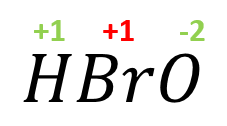
El bromo trabaja con su número de oxidación +1.
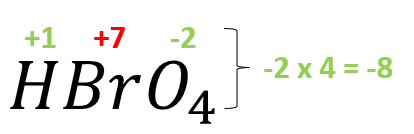
El bromo trabaja con su número de oxidación +7.
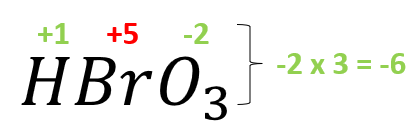
El bromo trabaja con su número de oxidación +5.
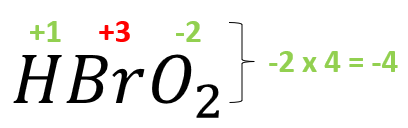
El bromo trabaja con su número de oxidación +3.
El orden ascendente es:
- HBrO (1)
- HBr{O}_{2} (4)
- HBr{O}_{3} (3)
- HBr{O}_{4} (2)
La respuesta correcta es la opción A.
Conoce los pasos para aplicar a la universidad: Todo sobre la convocatoria del IPN.
Reactivo 13
Calcular el porcentaje de sodio presente en el N{a}_{2}S{O}_{4} . Los pesos atómicos están expresados en g/mol:
Na = 23; S = 32; O = 16
- 11.4
- 22.4
- 32.4
- 42.4
Solución:
Para conocer la composición porcentual de un elemento se necesita el peso molecular de la sustancia.
Número de átomos por masa atómica
- Na: 23 g/mol\times 2=46 g/mol
- S: 32 g/mol
- O: 16 g/mol \times 4=64 g/mol
PM del {Na}_{2}S{O}_{4}=\left(46+32+64\right) g/mol=142 g/mol
PM del {Na}_{2}S{O}_{4}=142 g/mol
El porcentaje de sodio se encuentra al dividir la masa del elemento entre la masa del compuesto y el resultado se multiplica por 100:
\%=\frac{Masa del elemento}{Masa del compuesto}\times 100
\%S:\frac{46 g Na}{142 g N{a}_{2}S{O}_{4}}\times 100=32.4\%
El porcentaje de sodio presente en el compuesto es 32.4%. la respuesta correcta es la opción C.
Conoce la oferta académica completa del Instituto Politécnico Nacional: Lista de carreras del IPN por área.
Reactivo 14
Asociar la ecuación química con el tipo de reacción:

- 1B, 2D, 3D, 4A
- 1C, 2A, 3D, 4B
- 1D, 2A, 3B, 4C
- 1A, 2B, 3C, 4D
Solución:
Las reacciones químicas representan el proceso de combinación de dos o más sustancias para formar otras nuevas y diferentes. Existen diferentes tipos, entre ellas:
Las reacciones de descomposición o análisis son aquellas donde hay una ruptura o separación de los componentes de una especie química. Como lo refleja la ruptura del dióxido de plomo en la ecuación:
2Pb{O}_{2\left(s\right)}\to Pb{O}_{\left(s\right)}+{O}_{2\left(g\right)}
Una guía para reconocer las reacciones de descomposición es que en los reactantes siempre hay un solo elemento y en los productos hay dos o más que se generaron luego de su descomposición, la cual pudo ser causada por electricidad, calor, acción enzimática, entre otros. Relación 2A
Las reacciones de doble sustitución también conocidas como metátesis, que significa un cambio en la sustancia, en el estado o en la forma. Se evidencian por la ruptura de las especies químicas seguida de un reordenamiento de los componentes. Así lo expresa la ecuación química:
N{H}_{4}C{l}_{\left(ac\right)}+{H}_{2}{O}_{\left(l\right)}\to N{H}_{4}O{H}_{\left(ac\right)}+HC{l}_{\left(ac\right)}
Se observa puntualmente el doble cambio de elementos en los productos de la reacción con respecto a los reactantes. Relación 4B.
Las reacciones de síntesis son las más sencillas. En ellas existe la unión de dos o más especies químicas que originan un producto con características completamente diferentes. Tal es el caso de la reacción:
Fe+{O}_{2}\to FeO
Las reacciones de simple sustitución o sustitución simple son aquellas en las que reacciona un elemento y un compuesto. En ellas el elemento con mayor reactividad química sustituye a otro elemento del compuesto. Tal como lo expresa la reacción:
A{l}_{\left(s\right)}+3{H}_{2}S{O}_{4}\to {H}_{2\left(s\right)}+A{l}_{2}{\left(S{O}_{4}\right)}_{3\left(ac\right)}
Se observa que reacciona el elemento aluminio con el ácido sulfúrico y como es de mayor reactividad sustituye al hidrógeno formato sulfato de aluminio. Relación 3D.
Las relaciones correctas son: 1C, 2A, 3D, 4B por lo que la respuesta es la opción B.
Reactivo 15
La siguiente imagen representa el fenómeno de:
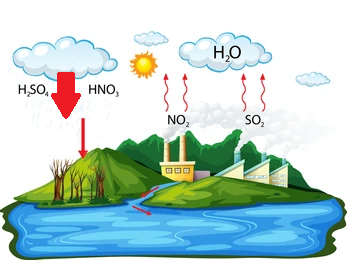
- Lluvia ácida
- Lluvia ciclonal
- Efecto invernadero
- Calentamiento global
Solución:
La lluvia ácida es otra forma de contaminación ambiental que surge como respuesta a las actividades industriales del hombre y la emisión de gases de automóviles que funcionan con combustibles fósiles. Se origina cuando las gotitas de agua presentes en el aire entran en contacto con compuestos químicos como el C{O}_{2} , N{O}_{2} , CO, S{O}_{4} , entre otros. Suben a la atmósfera y combinados con el {H}_{2}O dan productos ácidos como el HN{O}_{3}, {H}_{2}S{O}_{4} que caen a la tierra con las precipitaciones y causan daños graves al suelo, agua y vegetación.
Respuesta correcta opción A.
Reactivo 16
¿Qué tipo de isomería se observa en la siguiente imagen?
C{H}_{3}-C{H}_{2}-OH C{H}_{3}-O-C{H}_{3}
- Óptica
- Cadena
- Funcional
- Geométrica
Solución:
A simple vista se observa que lo único que cambia es el grupo funcional del compuesto, siendo:
- Un alcohol C{H}_{3}-C{H}_{2}-OH
- Un éter C{H}_{3}-O-C{H}_{3}
Sin embargo, si contamos la cantidad de átomos de carbono, oxígeno e hidrógeno en cada compuesto, vemos que esta no varía:
- Cantidad de átomos del alcohol: {C}_{2}{H}_{6}O
- Cantidad de átomos del éter: {C}_{2}{H}_{6}O
En este sentido, su fórmula molecular {\mathit{C}}_{2}{\mathit{H}}_{6}\mathit{O} es invariable y lo único que cambia es el grupo funcional, por ello se trata de una isomería de función, las cuales son las que más difieren entre sí porque el compuesto adquiere propiedades físicas y químicas completamente diferentes.
Respuesta correcta opción C.
¿Sabes cuántos puntos necesitas para quedar? Conoce los aciertos por carrera del IPN.
Reactivo 17
Asociar la función química orgánica con el compuesto.
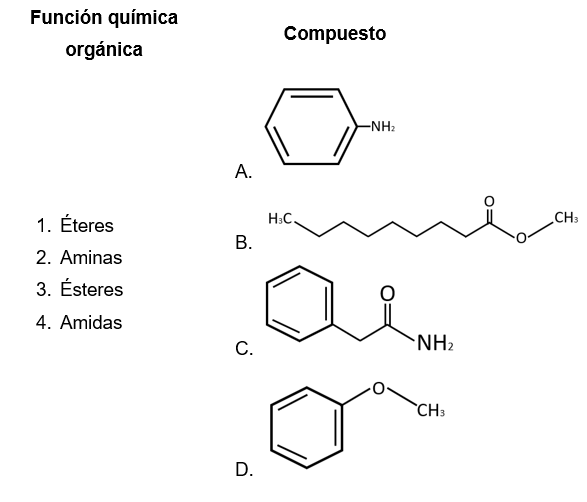
- 1A, 2D, 3C, 4B
- 1D, 2A, 3B, 4C
- 1A, 2B, 3C, 4D
- 1D, 2B, 3C, 4A
Solución:
Los éteres son compuestos que tienen dos átomos de carbono unidos a un oxígeno común (C-O-C) . Identificamos este patrón en la fórmula:
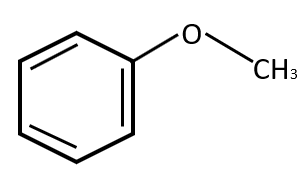
Recuerda que cada unión representa un carbono a menos que se indique lo contrario. Relación 1D.
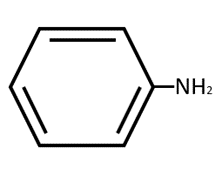
Las aminas poseen un átomo de carbono unido a un nitrógeno {H}_{3}C-N{H}_{2} . Relación 2A. Se evidencia en la fórmula:
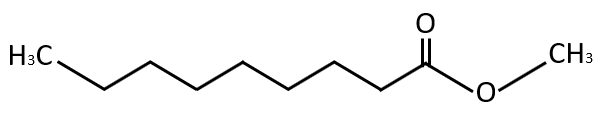
Los ésteres son derivados de los ácidos carboxílicos y se originan por la sustitución del H por un radical alquilo. Relación 3B. Como lo representa la fórmula:
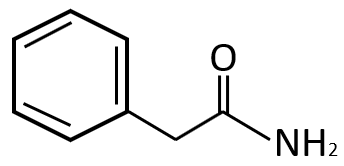
Las amidas también son derivados de los ácidos carboxílicos que reemplazan el OH del ácido carboxílico por un grupo -N{H}_{2} . Relación 4C.
La respuesta correcta es la opción B.
Reactivo 18
Asociar el tipo de carbono señalado con los números de la estructura química con su compuesto.
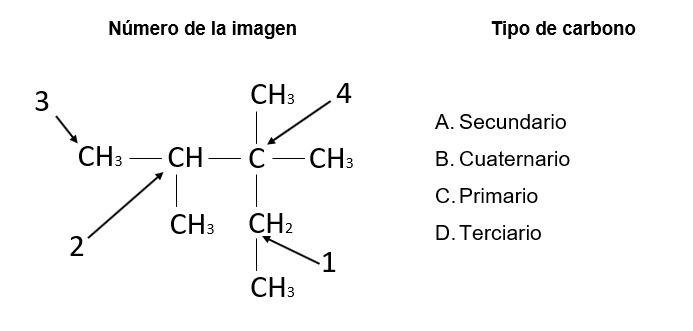
- 1A, 2B, 3C, 4D
- 1A, 2D, 3C, 4B
- 1A, 2C, 3D, 4B
- 1A, 2C, 3B, 4D
Solución:
Los átomos de carbono que se encuentran formando cadenas carbonadas se clasifican de acuerdo al número de átomos de carbono adicionales unidos a él.
- Carbono primario: N° de átomos de carbono unidos a él 1. Siempre son terminales.
- Carbono secundario: N° de átomos de carbono unidos a él 2. Siempre se localizan en el intermedio de la cadena.
- Carbono terciario: N° de átomos de carbono unidos a él 3. Siempre son intermedios.
- Carbono cuaternario: Se halla rodeado completamente de átomos de carbono. Siempre son intermedios.
Los tipos de carbonos que presenta el compuesto del enunciado son los siguientes:
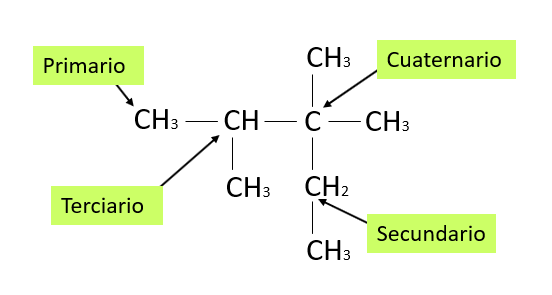
Las relaciones correctas son 1A, 2D, 3C, 4B, por lo tanto, la respuesta adecuada es la B.
Reactivo 19
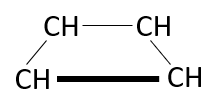
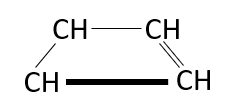
Identificar la estructura del butadieno
Solución:
El butadieno es un compuesto orgánico del grupo de los alquenos. El nombre nos indica que posee en su estructura dos dobles enlaces por la terminación –dieno. En base a ello, podemos descartar las opciones A, B y C, ya que no cumplen con la nomenclatura del compuesto, por ello y como lo dictan las reglas de la nomenclatura, la estructura del butadieno es:
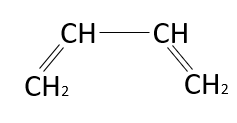
Respuesta correcta opción D.
Reactivo 20
Los _________ como el petróleo, vertidos en los océanos, originan diferentes problemas fisiológicos y alteraciones genéticas.
- Halógenos.
- Hidrógenos.
- Hidrocarburos.
- Metales pesados.
Solución:
El petróleo, en muchas ocasiones definido como crudo, se extrae de los yacimientos que contienen restos de materia orgánica fosilizada de la prehistoria. Los principales componentes del crudo son los hidrocarburos como los alcanos, algunos aromáticos y otros compuestos de menor importancia (e indeseables) como el azufre y el nitrógeno, que se consideran contaminantes y hacen que varíe el precio del petróleo de una región a otra.
Los derrames de petróleo traen consecuencias ambientales catastróficas, ya que es apolar, altamente hidrofóbico que cuando se vierte sobre la superficie de los mares, crea condiciones de hipoxia para la vida marina y demás consecuencias devastadoras para los ecosistemas.
Con base en la justificación teórica la respuesta correcta es la opción C.
Reactivo 21
La __________ es la cantidad de materia y el ___________ es el espacio que ocupa un cuerpo, mientras que la __________ indica la cantidad de calor.
- Temperatura – nivel – masa.
- Estructura – peso – gravedad.
- Gravedad – calor – estructura.
- Masa – volumen – temperatura.
Solución:
- La masa es la cantidad de materia que posee un cuerpo. Las unidades que utiliza son gramos, kilogramos, miligramos.
- El volumen es el espacio total ocupado por el cuerpo. Las unidades que utilizan son los litros, mililitros, centilitros.
- La temperatura indica la cantidad de calor de un cuerpo. Las unidades que utiliza son Celsius, Fahrenheit y Kelvin.
Respuesta correcta opción D.
Reactivo 22
Relacionar la solución empírica con sus respectivas propiedades:

- 1B, 2C, 3D, 4A
- 1B, 2D, 3C, 4A
- 1C, 2A, 3B, 4D
- 1C, 2B, 3A, 4D
Solución:
Una solución se define como una mezcla homogénea de dos o más sustancias, construidas por un soluto que se encuentra disperso en un solvente, que puede ser agua, por ejemplo. Las definiciones correspondientes para cada tipo de solución son las siguientes:
- Solución concentrada: Presenta una cantidad de soluto elevada respecto a la cantidad de solvente. Relación 1B.
- Solución diluida: Presenta poca cantidad de soluto en relación con la cantidad del solvente. Relación 2C.
- Solución saturada: Presenta una máxima cantidad de soluto que el solvente puede disolver a temperatura ambiente. Relación 3D.
- Solución sobresaturada: Presenta una cantidad de soluto que sobrepasa la capacidad de disolución del solvente y se requiere aumentar la temperatura para solubilizar el exceso de soluto. Relación 4A.
Respuesta correcta opción A.
Reactivo 23
Seleccionar el soluto y el solvente al mezclar 1 cucharada de café con 2 de azúcar en 250 ml de agua.
- Solutos: café y azúcar; solvente: agua.
- Soluto: agua; solvente: café y azúcar.
- Solutos: agua y azúcar; solvente: café.
- Soluto: azúcar; solventes: agua y café.
Solución:
Recuerda que el solvente disuelve a los solutos. Por ello, los solutos serán el azúcar y el café que se disolverán en el agua, el cual es el solvente universal.
Respuesta correcta opción A.
Reactivo 24
Determinar los coeficientes estequiométricos para balancear la ecuación:
___ C{H}_{4}+ ____ {O}_{2}\to ____ C{O}_{2}+ ____ {H}_{2}O
- 2, 2, 1, 2
- 1, 2, 1, 2
- 4, 2. 4, 2
- 2, 1, 2, 1
Solución:
Los coeficientes estequiométricos adecuados serán aquellos que igualen la cantidad de átomos a ambos lados de la reacción.
C{H}_{4}+{O}_{2}\to C{O}_{2}+{H}_{2}O

Los coeficientes estequiométricos se asignan por tanteo.
C{H}_{4}+2{O}_{2}\to C{O}_{2}+2{H}_{2}O
Verificamos la cantidad de átomos nuevamente para saber si el ajuste fue correcto:

La respuesta correcta es la opción B.
Reactivo 25
Relacionar el producto de la ecuación química con su grupo funcional.

- 1C, 2D, 3B, 4A
- 1C, 2D, 3A, 4B
- 1B, 2C, 3D, 4A
- 1B, 2D, 3C, 4A
Solución:
Los hidrácidos se forman por la unión de un no metal más oxígeno, como se observa en la reacción:
C{l}_{2}+{H}_{2}\to 2HCl
Los hidruros resultan de la combinación de un metal más hidrógeno, como se aprecia:
Pb+{H}_{2}\to Pb{H}_{2}
La sal binaria es un compuesto formado por la combinación de un metal más un no metal.
2Li+C{l}_{2}\to 2LiCl
Los hidróxidos son compuestos alcalinos que poseen el grupo –OH en su estructura. Como lo refleja la reacción:
Ca+{H}_{2}O\to Ca{\left(OH\right)}_{2}+{H}_{2}
Respuesta correcta opción B.