Si tienes problemas para comprender la estructura atómica en este post te explicamos todo lo que necesitas saber acerca de la partícula más pequeña que conforma la materia.

Descubre cómo los protones se mantienen en el núcleo sin repelerse entre ellos y comprende la resolución de ejercicios de la estructura atómica.
¿Qué es un átomo?
El origen de la palabra átomo se remonta a los años 470 a 360 a.C. El filósofo griego Demócrito con su nueva corriente de pensamiento científico postuló que la materia estaba compuesta por pequeñas partículas diminutas,
La palabra átomos significa indivisible. Y fue utilizado por Demócrito para definir una “partícula indivisible”. En el siglo XIX la química adoptó el término para describirlo como lo conocemos actualmente, según la teoría atómica de Dalton:
La estructura atómica de la materia
Por mucho tiempo se pensó que el átomo era indivisible, pero las diferentes teorías que se desarrollaron a lo largo de los años dejaron en claro que esto no era así.
El átomo se compone de un núcleo, el cual es la parte central, allí se encuentran los protones y los neutrones. Es la parte con mayor masa y posee una densidad de {10}^{13} a {10}^{14} g/c{m}^{3} .
La corona electrónica es la parte exterior del núcleo en donde se encuentran orbitando los electrones alrededor del centro. Ocupan la mayor parte del volumen del átomo. El diámetro de la corona electrónica siempre es superior al núcleo, aunque el núcleo posee mayor masa.
Los electrones y los protones determinan las propiedades químicas de los elementos. Los neutrones no participan en las reacciones químicas en condiciones normales.
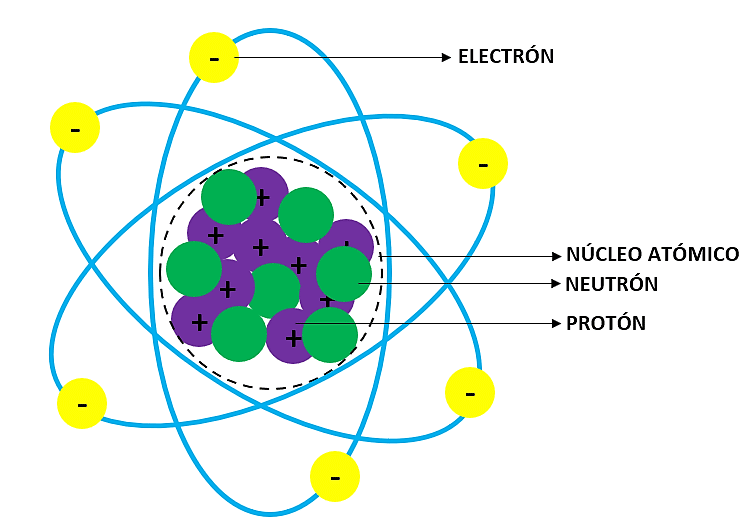
Estructura atómica con ejemplos
Por ejemplo, veamos la estructura atómica de un elemento de la tabla periódica.
El átomo de hidrógeno posee un núcleo con 1 protón y 0 neutrones y en la corona electrónica se encuentra 1 electrón:
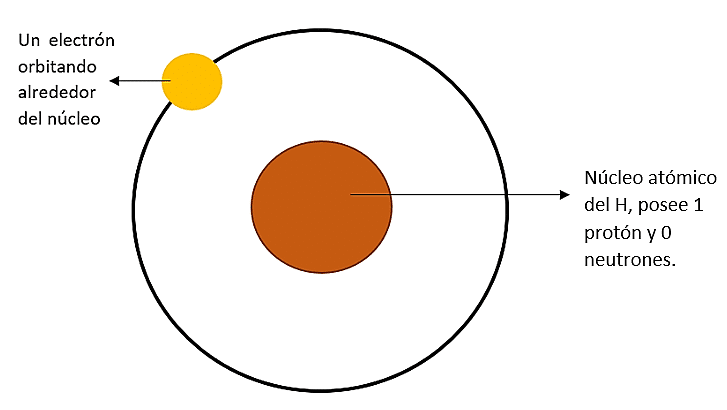
Representación esquemática de la estructura del átomo de hidrógeno
Partículas subatómicas
Las partículas subatómicas del átomo son los neutrones, protones (partículas nucleares) y electrones. Definamos cada una de ellas.
Electrones
Los electrones se denotan con el símbolo “e-“ su masa es de 9.10938 \times {10}^{28} g lo que evidencia que es muchísimo más liviano que un protón y la analogía es correcta debido a que los electrones se encuentran girando alrededor del núcleo atómico a grandes velocidades.
La unidad de carga electrónica es -1 y un átomo eléctricamente neutro tendrá la misma cantidad de protones y neutrones, como se menciona más adelante.
- Cuando los átomos pierden electrones se convierten en iones que poseen carga positiva y se denominan cationes.
- Cuando los átomos ganan electrones, adquieren carga negativa y se convierten en iones llamados aniones.
Partículas nucleares
Desde inicios del siglo XX se conocía que los átomos son eléctricamente neutros, para ello la cantidad de electrones y de protones debe ser la misma.
En el año 1910 el físico neozelandés Ernest Rutherford, propuso que las cargas positivas de los átomos estaban concentradas en un denso conglomerado central dentro del átomo, que llamó núcleo.
Las partículas con carga positiva presentes en el núcleo se denominan protones, su símbolo es p. En diversos experimentos se encontró que tienen la misma cantidad de carga que los electrones.
La masa del protón es de 1.67262 \times {10}^{-24} g igual a la del átomo de hidrógeno, recordemos que el átomo de H posee un solo protón en el núcleo.
Proporciona una identidad química para cada elemento, por ejemplo:
El número atómico del cloro (Cl) es 17, esto significa que cada átomo de Cl posee 17 protones y 17 electrones. Pero, analizando su identidad química, podemos decir que cada átomo presente en el universo que contiene 17 protones será reconocido como “cloro”.
Experimentos posteriores a los de Rutheford demostraron que el átomo está formado por un tercer tipo de partículas subatómicas, que Chadwick llamó neutrones.
Los neutrones son partículas eléctricamente neutras, con una masa similar a los protones, pero sutilmente por encima de ellos 1.67493 \times {10}^{-24} g.
El total de neutrones presentes en el núcleo atómico se representa con la letra N.
La regla excluye al hidrógeno, ya que en su núcleo se halla un protón y existe la ausencia de neutrones.
Número de masa = número de protones + número de neutrones
A = Z + N
En un elemento los valores numéricos expresados se representan de la siguiente manera:
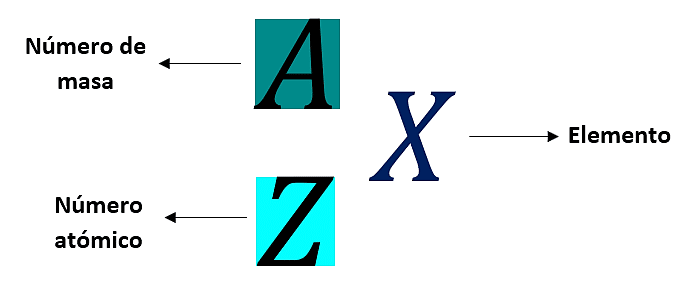
Existen diferentes elementos que contienen igual número de protones, pero difieren entre ellos en cuanto al número de neutrones y se denominan isótopos. En otras palabras, los isótopos tienen el mismo número atómico, pero difieren en el número de masa.
Ejemplo de los isótopos del hidrógeno, como hemos estudiado el hidrógeno tiene solamente un protón en el núcleo y ausencia de electrones, pero sus isótopos serían:
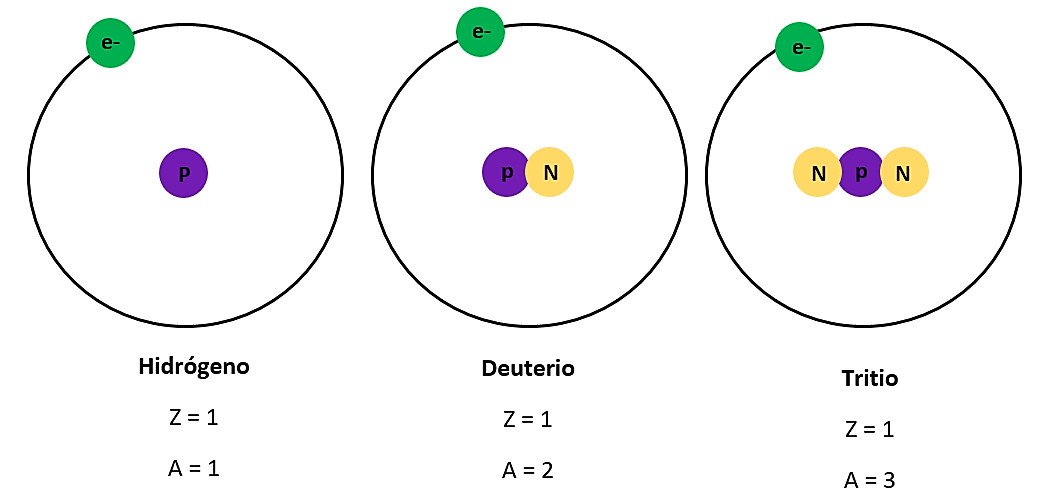
Como lo muestra el ejemplo, los isótopos del hidrógeno posee un mismo número de protones, pero difieren en el número de neutrones, el deuterio es {}_{1}{}^{2}H posee 1 neutrón y el tritio es {}_{1}{}^{3}H posee dos neutrones.
El modelo atómico actual
En la actualidad se estima que los electrones tienen un comportamiento ondulatorio.
Erwin Schrödinger ideó la ecuación de onda para explicar la dualidad de la materia (con carácter onda – partícula). La solución de dicha ecuación es la función de onda que depende de tres variables conocidas como números cuánticos (s, l, m, n).
La ecuación de onda de Schrödinger origina el concepto de un orbital atómico, el cual es el espacio con mayor probabilidad en el que se encuentre un electrón. Sin embargo, los orbitales no son una entidad física sino matemática, por lo que el estudio del átomo es bastante abstracto en la actualidad.
¿Qué es la fuerza nuclear fuerte?
Cuando estudiamos la estructura atómica puede surgir la pregunta ¿Cómo se mantienen unidos los protones en el núcleo del átomo si cargas iguales se repelen entre sí? La respuesta es gracias a la fuerza nuclear fuerte.
También llamada interacción nuclear fuerte, es la fuerza que supera la tendencia de repulsión entre elementos de la misma carga, es decir, evita la repulsión de los protones. Actúa entre las partículas subatómicas muy cercanas unas de otras manteniendo las interacciones protón – neutrón y neutrón – protón.
Ejemplos de ejercicios de estructura atómica
Ejemplo 1
¿Cuál de los siguientes átomos es un catión y explique porque se considera así atómicamente:
N{a}^{+}-C{l}^{-}-{O}_{2}
Entre los elementos del enunciado, el catión es el N{a}^{+} debido a que perdió un electrón y ganó carga positiva.
Ejemplo 2
¿Cuál es la cualidad que define a los siguientes elementos como isótopos?
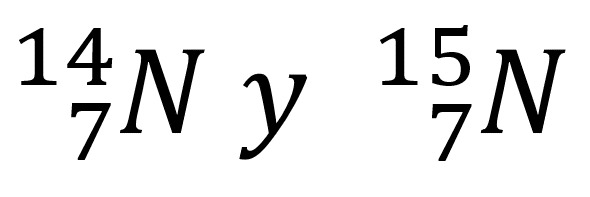
Se consideran isótopos del nitrógeno porque poseen igual número de protones, pero difieren en el número de neutrones.
Ejemplo 3
Si el mercurio tiene una masa atómica de 200 y su número atómico es igual a 80 ¿Cuántos neutrones y electrones posee?
Recordemos que la masa atómica o número de masa es la suma del número de neutrones y el número de protones.
A=N+P
Cuando queremos conocer el número de neutrones despejamos N de la ecuación y nos queda:
N=A-P
Por lo tanto, la cantidad de neutrones del Hg será:
N=200-80=120
N=120
Como el átomo no está cargado, es decir, se encuentra en estado neutro el la cantidad de protones será igual a la cantidad de electrones, por lo tanto el Hg posee 80 e-.


