Hola aspirante, continuamos con la tercera parte del examen simulador de química para carreras del área de ciencias médico biológicas (CMB), vamos a resolver los ejercicios del 31 al 45.

Reactivo 31
Si se tienen una mezcla de dos líquidos miscibles entre sí, y se desea separar uno de ellos para fines analíticos, ¿Cuál es el método de separación de mezclas que se debe utilizar?
- Centrifugación
- Imantación
- Filtración
- Destilación
Solución:
Cuando se desea separar dos líquidos miscibles entre sí el método de separación de mezclas adecuado es la destilación. La destilación es una técnica para separar dos líquidos miscibles entre sí, con diferentes puntos de ebullición. Amerita la aplicación de procesos físicos como la evaporación y la condensación.
La técnica consiste en someter a altas temperaturas las sustancias solubles entre sí. El líquido que tiene menor punto de ebullición, al evaporarse de forma más rápida, pasa a través de un tubo de destilación. En el tubo de destilación, el vapor de la sustancia se somete a bajas temperaturas para que se condense y vuelva al estado líquido en otro recipiente. De esta manera se realiza la separación de dos líquidos presentes en una mezcla homogénea.
Mientras mayor es la diferencia entre los puntos de ebullición de cada sustancia, mejor será la separación de los líquidos destilados.
Respuesta correcta opción D.
Reactivo 32
Una molécula se define como la unión de átomos iguales o diferentes mediante un enlace químico para formar estructuras de diversa complejidad. Por lo tanto, una molécula siempre se considera:
- Poliatómica
- Monoatómica
- Diatómica
- Triatómica
Solución:
Una molécula es la asociación de dos o más átomos, por ello siempre se considera poliatómica. Dependiendo de la cantidad de átomos involucrados y los enlaces de unión las moléculas formadas tienen diferentes niveles de complejidad.
Respuesta correcta opción A.
Reactivo 33
De las siguientes opciones, selecciones las sustancias más abundantes en la corteza terrestre:
- Oxígeno
- Aluminio
- Hierro
- Cobre
- Estaño
- 1, 2 ,3
- 1, 3, 5
- 2, 4, 2
- 1, 4, 5
Solución:
La extensión de la corteza terrestre es de aproximadamente 40 kilómetros, desde la superficie hasta el centro de la tierra. Sin embargo, las porciones internas no han sido estudiadas a profundidad debido a los retos técnicos que presenta.
No obstante, se cree que en el centro del planeta hay un núcleo sólido de hierro y en sus adyacencias se encuentra una capa de fluido a altas temperaturas llamado manto, compuesto por hierro, silicio, azufre y carbono.
De los 83 elementos presentes en la naturaleza, 12 constituyen 99.7% de la masa de la corteza terrestre. Ellos no están distribuidos de manera uniforme sobre la tierra y la mayoría se encuentra combinado con otros elementos. En orden decreciente de abundancia son:
- Oxígeno
- Silicio
- Aluminio
- Hierro
- Calcio
- Magnesio
- Sodio
- Potasio
- Titanio
- Hidrógeno
- Fósforo
- Manganeso
Con base en ello los elementos del enunciado son oxígeno, hierro y aluminio.
Respuesta correcta opción A.
Reactivo 34
Selecciona, entre las siguientes opciones, los compuestos químicos que correspondan a óxidos básicos:
- L{i}_{2}O
- {P}_{2}{O}_{3}
- CuO
- B{r}_{2}O
- MnO
- 1, 2, 3
- 2, 4, 5
- 1, 3, 5
- 3, 4, 5
Solución:
Los óxidos básicos son compuestos formados por la unión de un elemento metálico y el oxígeno. De las opciones presentes en el enunciado podemos identificar:
- Óxido de litio \left(L{i}_{2}O\right)
- Óxido de cobre (II) \left(CuO\right)
- Óxido de manganeso (II) \left(MnO\right)
Respuesta correcta opción C.
Reactivo 35
Identifique los enlaces presentes en la siguiente estructura de Lewis:
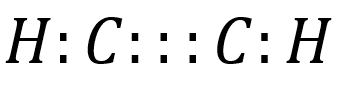
- Solo enlaces covalentes
- Un enlace covalente y dos enlaces iónicos
- Solo enlaces iónicos
- Dos enlaces iónicos y uno covalente
Solución:
La estructura del Lewis que muestra el enunciado representa el acetileno, un compuesto orgánico que presenta un triple enlace.
H-C\equiv C-H
Todos los enlaces de la molécula son covalentes, posee dos enlaces covalentes sencillos y un enlace covalente triple.
Respuesta correcta opción A.
Reactivo 36
En las reacciones de óxido-reducción, la suma algebraica de los números de oxidación de todos los átomos presentes en un compuesto neutro debe ser igual a:
- 0
- 1
- 2
- 3
Solución:
En las reacciones de óxido-reducción, la suma algebraica de los números de oxidación de todos los átomos presentes en un compuesto neutro debe ser igual a cero. Por ejemplo:
{H}_{2}O
Los números de oxidación para la molécula de agua son:
\begin{array}{c}+1\\ {H}_{2}\end{array}\begin{array}{c}-2\\ O\end{array}
El número de oxidación se multiplica por la cantidad de átomos del elemento y se realiza la suma algebraica, es decir:
\left(+1\times 2\right)-2
+2-2=0
Respuesta correcta opción A.
Reactivo 37
El químico francés Joseph Louis Proust enunció la _______________, la cual establece que cuando dos o más elementos se combinan para originar un compuesto, lo hacen en una relación fijade masa.
- Ley de la conservación de la masa.
- Ley de las proporciones variadas.
- Ley de las proporciones definidas.
- Ley de conservación de la materia.
Solución:
El químico francés Joseph Louis Proust enunció la ley de las proporciones definidas, la cual establece que cuando dos o más elementos se combinan para originar un compuesto, lo hacen en una relación fijade masa.
Respuesta correcta opción C.
Reactivo 38
En las reacciones de óxido-reducción, el _________________ se asigna a los reactivos y a los productos para indicar la transferencia de electrones.
- Número de oxidación.
- Electrón.
- Átomo neutro.
- Valor de protones.
Solución:
En las reacciones de óxido-reducción, el número de oxidación se asigna a los reactivos y a los productos para indicar la transferencia de electrones. La ganancia y pérdida de electrones es imprescindible en el balanceo de ecuaciones redox.
En otras palabras, si una sustancia pierde determinado número de electrones durante una reacción, otra sustancia tiene que ganar el mismo número de electrones y todo se evidencia gracias a los cambios del número de oxidación antes y después de la reacción.
Respuesta correcta opción A.
Reactivo 39
El {H}_{3}P{O}_{4} es un ácido incoloro y líquido que se utiliza en detergentes, fertilizantes y gaseosas para “potenciar” el sabor. Calcule la composición porcentual del H presente en el compuesto.
Considere que la masa molar del {H}_{3}P{O}_{4} es igual a 98 g/mol y la masa atómica de cada átomo es (g/mol): H = 1, P = 31 y O = 16
- 3
- 40
- 7
- 25
Solución:
Para conocer el porcentaje de hidrógeno presente en el compuesto {H}_{3}P{O}_{4} , dividimos la masa atómica del H (multiplicada por la cantidad de átomos presentes) entre el peso molecular del compuesto y multiplicamos por 100.
\%H=\frac{3 g/mol}{98 g/mol}\times 100=3\%
\%H=3
El porcentaje de hidrógeno presente en el total de ácido fosfórico es de 3%.
Respuesta correcta opción A.
Reactivo 40
El tipo de hibridación s{p}^{2} contiene:
- Un enlace sigma y dos enlaces pi.
- Un enlace sigma y un enlace pi.
- Dos enlaces sigma y un enlace pi.
- Es un enlace simple.
Solución:
La hibridación se da cuando un orbital s se combina con dos orbitales p, dando como resultado tres orbitales híbridos s{p}^{2} y un orbital s puro. Se presenta en carbonos con enlace doble = . Los tres orbitales 2 están en un plano y forman ángulos de 120° entre sí con el orbital p restante perpendicular al plano 2.
Debido a su configuración, poseen un enlace sigma y un enlace pi.
Respuesta correcta opción B.
Reactivo 41
Nombre del siguiente compuesto:
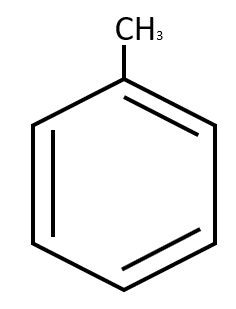
- Metil benceno
- Etil benceno
- Tolueno
- Ácido benzoico
Solución:
Comúnmente conocido como tolueno, también se nombra metilbenceno.
Respuesta correcta opción C.
Reactivo 42
La ecuación del gas ideal, PV = nRT combina las leyes de ___________, ____________ y ___________ para explicar el comportamiento de un gas ideal.
- Boyle, Charles y Avogadro
- Avogadro, Gay-Lussac y Dalton
- Dalton, Avogadro y Chales
- Charles, Dalton y Gay-Lussac
Solución:
La ecuación del gas ideal, PV = nRT combina las leyes de Boyle, Charles y Avogadro para explicar el comportamiento de un gas ideal.
Robert Boyle (1627-1691) fue un químico inglés y filósofo natural al que se le conoce en mayor medida por sus contribuciones a la ley de los gases. Pero, no fue lo único que realizó, también fue el primero en establecer diferencias entre las mezclas y los compuestos. En física, aseveró que el sonido no se propaga en el vacío y explico el papel fundamental del aire en el proceso. Fue un investigador con carácter que no estaba de acuerdo con los pensadores de su época y sus ideas influyeron en muchos químicos futuros gracias a su obra “el químico escéptico”.
Por su parte, Jacques Charles fue un científico, inventor y matemático francés que realizó diferentes aportaciones a la ciencia, entre ellas el volumen de una cantidad fija de gas que se mantiene a presión constante es proporcional a la temperatura absoluta del gas, conocida como la Ley de Charles. Sin embargo, Joseph Louis Gay-Lussac, químico y físico francés, poco después de Charles publicó la cómo afecta el cambio de temperatura al volumen y presión de un gas, por lo que a menudo a ambas aportaciones estudiaron la misma relación, y a sus leyes se les conoce como ley de Charles y de Gay-Lussac o simplemente ley de Charles.
Amadeo Avogadro fue un científico de origen italiano que complementó los estudios de Boyle, Charles y Gay-Lussac. En el siglo XIX año 1811 estableció que, a una misma presión y temperatura, diferentes gases con volúmenes iguales contienen el mismo número de moléculas (o átomos en caso de gases monoatómicos). Por ello, el volumen de cualquier gas es proporcional al número de moles de las moléculas presentes.
Los aportes de Boyle, Charles y Avogadro permitieron describir la relación entre presión, temperatura, volumen y número de moles que explica el comportamiento de un gas ideal.Respuesta correcta opción A.
Reactivo 43
La expresión de concentración de una disolución que utiliza el peso equivalente de la sustancia en estudio es:
- Molalidad.
- Molaridad.
- Fracción molar.
- Normalidad.
Solución:
La normalidad es una unidad de concentración que relaciona los equivalentes del soluto presentes en un litro de disolución. Para conocer los equivalentes del soluto, se utiliza la relación de la masa del soluto y el peso equivalente.
Respuesta correcta opción D.
Reactivo 44
Si se tiene una bebida de té, a la que se le añade una gran cantidad de azúcar, superior a la que el disolvente pude disolver en él, la bebida tendrá una concentración:
- Saturada
- Diluida
- Concentrada
- Sobresaturada
Solución:
El caso que refleja el enunciado es el ejemplo de una disolución sobresaturada. En ella existe una cantidad de soluto superior a la que el disolvente es capaz de aceptar.
Respuesta correcta opción D.
Reactivo 45
La ___________ es el término que suele aplicarse al deterioro de los metales por un proceso electroquímico.
- Electrólisis.
- Electroforesis.
- Corrosión.
- Descomposición.
Solución:
La corrosión es el término que suele aplicarse al deterioro de los metales por un proceso electroquímico.
Respuesta correcta opción C.


