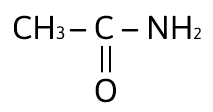¡Hola aspirante! Resolvamos paso a paso los 13 reactivos de química comprendidos desde el 23 al 35 que pertenecen a la guía de estudio UNAM Área 2 de las Cs. biológicas, químicas y de la salud.

¿Cómo tener un puntaje alto en el examen de admisión? Aunque la contestación parece obvia, estudiar no es la respuesta absoluta.
Teniendo en cuenta que una de las carreras con mayor tasa de rechazo se encuentra en área 2. Para conseguir la cantidad de aciertos necesarios debes tener un aprendizaje activo (utilizando guías de estudio como la que te traemos), conocer todo lo referente al examen y no dudar de tus capacidades.
Estructura del examen
El índice de aceptación, por lo menos, para medicina fue de 1.3 %, es decir, fueron rechazadas más de 20,000 personas. A pesar de ello, existen posibilidades y nuestro trabajo es darte las herramientas para que seas admitido.
Uno de los primeros pasos es conocer la estructura del examen, área 2:
- Comprende 120 reactivos distribuidos en nueve diferentes materias.
- Tiene una duración exacta de tres horas, ni más ni menos.
- El enfoque principal para área 2 es química y biología, a diferencia de otras, como por ejemplo, área 1 enfocada en física y matemáticas.
Estructura del examen área 2
| Temas | Área 2 |
|---|---|
| Español | 18 |
| Matemáticas | 24 |
| Física | 12 |
| Química | 13 |
| Biología | 13 |
| Historia universal | 10 |
| Historia de México | 10 |
| Literatura | 10 |
| Geografía | 10 |
| Filosofía | NA |
| Total | 120 |
Además de medicina, existen otras carreras pertenecientes al área de ciencias biológicas, químicas y de la salud con alto índice de rechazo como lo son:
- Enfermería.
- Psicología.
- Cirujano dentista.
- Medicina veterinaria zootecnista.
- Biología.
Área 2 posee nueve de las 26 carreras de ingreso indirecto ofertadas en la UNAM. En ellas se evalúan habilidades adicionales, además de las que requiere la prueba de ingreso. Por ejemplo debes superar:
- Examen de conocimientos.
- Examen de inglés.
- Examen psicométrico.
- Ensayos, entre otros.
Todo depende de la carrera seleccionada. Alguna de ellas son:
- Ciencias genómicas
- Neurociencias
- Órtesis y prótesis
- Fisioterapia
- Ciencia forense
- Ciencias agrogenómicas
- Ciencias de la nutrición humana
El siguiente paso, luego de conocer la estructura del examen, es saber con exactitud los temas que debes estudiar.
Temario de química área 2
Lista completa de los puntos que abarca el módulo de química del área de ciencias biológicas, químicas y de la salud.
- Temas básicos
- Sustancias químicas
- Sustancias puras: elemento y compuesto
- Mezclas: homogéneas y heterogéneas
- Estructura atómica
- Conceptos de átomo, protón, electrón, neutrón, número atómico y masa atómica
- Tabla periódica
- Clasificación de elementos: metales, no metales y metaloides
- Regla del octeto de Lewis
- Propiedades periódicas
- Electronegatividad y tipos de enlace: iónico y covalente
- Clasificación de los compuestos en óxidos básicos, óxidos ácidos (anhídridos), ácidos, bases y sales
- Mol
- Concepto
- Cálculo de masa molar
- Sustancias químicas
- Agua
- Composición del agua y estructura molecular
- Polaridad y puentes de hidrógeno
- Propiedades físicas: puntos de ebullición y de fusión, capacidad calorífica específica
- Propiedades químicas: tipo de enlace, capacidad (poder) disolvente del agua
- Ácidos y bases
- Clasificación por su conductividad: fuertes y débiles
- Diferenciación de las sustancias de acuerdo con su pH
- Indicadores y pH
- Soluciones o disoluciones
- Concepto de soluto y disolvente
- Contaminación del agua
- Principales contaminantes: físicos, químicos y biológicos
- Fuentes generadoras: industrial, urbana y agrícola
- Importancia y aplicaciones del agua para la humanidad
- Uso responsable y preservación del agua
- Composición del agua y estructura molecular
- Aire
- ¿Qué es el aire?
- Composición porcentual del aire
- Reacciones del oxígeno
- Reacciones de combustión
- Formación de óxidos básicos
- Formación de óxidos ácidos (nitrógeno, azufre y carbono)
- Reacciones de óxido-reducción
- Ciclos del oxígeno, nitrógeno y carbono
- Contaminantes del aire
- Contaminantes primarios del aire (óxidos de nitrógeno, carbono y azufre, partículas suspendidas e hidrocarburos
- Principales fuentes generadoras (industriales, urbanas y agrícolas)
- Impacto ambiental: inversión térmica y lluvia ácida
- Alimentos
- Carbohidratos
- Estructura
- Fuente de energía de disponibilidad inmediata
- Lípidos
- Estructura
- Almacén de energía
- Proteínas
- Grupos funcionales presentes en aminoácidos
- Enlace peptídico
- Vitaminas y minerales: fuentes e importancia
- Carbohidratos
- La energía y las reacciones químicas
- Reacciones químicas endotérmicas y exotérmicas
- Química del carbono
6.1 Carbono
6.1.1 Estructura tetraédrica
6.1.2 Tipos de enlace carbono-carbono: estructura y modelos
6.2 Alcanos, alquenos, alquinos y cíclicos
6.2.1 Nomenclatura
6.2.2 Isomería estructural
6.3 Grupos funcionales
6.3.1 Alcohol, éter, aldehído, cetona, ácidos carboxílicos, éster, animas, amidas y compuestos halogenados
6.3.2 Nomenclatura
6.4 Reacciones orgánicas
6.4.1 Reacciones de sustitución, adición y eliminación
6.4.2 Reacciones de condensación e hidrólisis
6.4.3 Reacciones de polimerización por adición y condensación
La química del carbono es un tema exclusivo para el módulo de química de área 2. Tiene sentido que sea así porque en ella se estudia las ciencias de la vida y el carbono está presente en todos los organismos vivos.
Tips para estudiar química efectivamente
- La química orgánica es tu nueva mejor amiga. En ella se estudia todo lo referente al carbono.
- Dibuja las estructuras. Es una técnica que ayuda a agilizar el reconocimiento y nomenclatura de muchas moléculas, principalmente orgánicas.
- Consulta con tus profesores ¡Cualquier duda es importante! No subestimes las interrogantes que te surgen a la hora de estudiar, siempre habla con tus profesores para que te despejen cualquier duda.
- ¡Planifícate! De ahora en adelante debes tomar cada uno de los puntos del temario y distribuirlos en un horario que se ajuste a tu semana para no perder el enfoque de formación.
- ¡Diviértete! Es esencial que realices actividades recreativas durante la semana para mejorar la apreciación cognitiva y memorizar mucho más.
Guía química UNAM área 2 resuelta
Iniciamos la guía de estudio resuelta de los 13 reactivos de química para el área de ciencias biológicas, químicas y de la salud. Optimiza el aprendizaje resolviendo por tu cuenta el ejercicio y luego confirmando la respuesta.
Reactivo 23
La especie {}_{34}{}^{78}S{e}^{2-} contiene ___ protones, ___ neutrones y ___ electrones.
- 44, 34, 44
- 34, 44, 36
- 78, 34, 80
- 78, 44, 36
Solución:
Para saber la cantidad de partículas subatómicas que posee el elemento, primero debemos conocer a qué se refiere cada valor como lo explica el siguiente esquema:
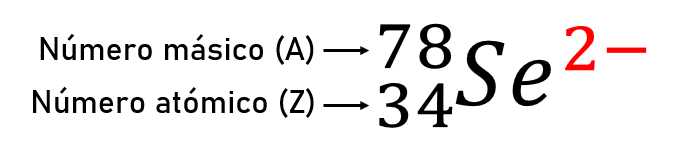
La cantidad de protones se conoce como número atómico (Z), es decir que el selenio posee 34 protones.
La suma de los protones y los neutrones del núcleo de un elemento se denomina número de masa o másico (A).
A=N+P
Para conocer la cantidad de neutrones, aplicamos el siguiente despeje:
N=A-P
N=78-34=44
N=44
En un átomo sin carga o en estado neutro la cantidad de electrones es igual a la de protones, pero en este caso el número resaltado en rojo del esquema (2-) indica que el átomo es un anión, ha ganado dos electrones, por ello, a 34 electrones se le suman dos y el total es de 36 e-
La respuesta correcta es la opción D.
Reactivo 24
¿Cuántos gramos equivalen a 0.5 mol de ácido fosfórico, {H}_{3}P{O}_{4} ?
- 49 g
- 24 g
- 98 g
- 48 g
Solución:
Lo primero que debemos hacer es conocer el peso molecular del ácido fosfórico, según las masas atómicas (g/mol): P=31;H=1;O=16
PM {H}_{3}P{O}_{4}=\left(1\times 3\right)+31+\left(4\times 16\right)=98 g/mol PM=98 g/molCon el valor encontrado podemos establecer el siguiente análisis: Si en 1 mol de ácido fosfórico hay 98 g ¿Cuántos gramos hay en 0.5 moles del compuesto?
La relación matemática es la siguiente:
g {H}_{3}P{O}_{4}=0.5 mol\times \frac{98 g}{1 mol}=49 g
En 0.5 moles de {H}_{3}P{O}_{4} hay 49 gramos del compuesto. La respuesta correcta es la opción A.
Reactivo 25
El agua es un disolvente polar debido a
- Su elevado punto de ebullición.
- La alta capacidad calorífica que presenta.
- Su elevada constante dieléctrica.
- La estructura angular de sus moléculas.
Solución:
El comportamiento particular del agua se debe a su estructura molecular, formada por un átomo de oxígeno y dos átomos de hidrógeno.
En ella, los dos pares de electrones compartidos entre ambos elementos, resultan atraídos con mayor fuerza por el átomo de oxígeno, ya que tiene una mayor electronegatividad (E = 3.5), donde se establece el polo de densidad negativa de la molécula de {H}_{2}O .
La zona de densidad positiva se ubica en los extremos de los átomos de H (E = 2.1) de menor electronegatividad con respecto al oxígeno.
Gracias a la diferencia de electronegatividades la molecula adquiere una disposición angular mediante enlaces covalentes polares.
En el mismo sentido, debido a la polaridad que poseen las moléculas de agua se atraen entre ellas con gran facilidad, es decir, un lado positivo de la molécula se asocia con el lado negativo de otra molécula de agua formando puentes de hidrógeno.
Su estructura le permite funcionar como un excelente disolvente polar. Sin embargo, sustancias apolares como los alcanos no se disuelven en agua, ya que no pueden formar puentes de hidrógeno con el agua.
Con base en la justificación teórica, concluimos que la respuesta correcta es la opción D.
Reactivo 26
Sustancias que al estar en disolución donan protones.
- Óxidos.
- Ácidos.
- Bases.
- Sales
Solución:
La definición que brinda el enunciado es el concepto de un ácido, el cual es toda sustancia que al estar en una disolución acuosa puede donar o ceder protones. Por ejemplo:
{H}_{2}C{O}_{2 \left(ac\right)}\leftrightarrow {H}^{+}+HC{O}_{3}^{-}
El ácido carbónico en disolución acuosa libera protones en forma de hidrogeniones \left({H}^{+}\right) .
La respuesta correcta es la opción B.
Reactivo 27
¿Cuál es la molaridad de una disolución que contiene 20 g de NaOH en 2 L de solución?
- 0.25 M
- 0.50 M
- 0.75 M
- 1.00 M
Solución:
La molaridad se representa con la letra “M” y se refiere a los moles de soluto disueltos en cada litro de solución a través de la siguiente expresión:
M= \frac{N° moles del soluto}{Volumen de la disolución en L }
El enunciado nos indica que la disolución contiene 20 g de NaOH, para calcular la molaridad necesitamos convertir los 20 g del compuesto a moles. Para ello calculamos el peso molecular del NaOH sabiendo que las masas atómicas (g/mol) son las siguientes: N=23;O=16;H=1
PM NaOH=23+16+1=40 g/mol
Establecemos la siguiente relación matemática para buscar los moles de NaOH:
N° de moles NaOH=20 g \times \frac{1 mol}{40 g}=0.5
N° moles NaOH=0.5
Sustituimos los valores en la ecuación:
M= \frac{0.5 mol}{2 L}=0.25
M=0.25
La respuesta correcta es la opción A.
Reactivo 28
Los dos principales componentes del aire son:
- Oxígeno y dióxido de carbono.
- Nitrógeno y oxígeno.
- Ozono y dióxido de carbono.
- Nitrógeno y ozono.
Solución:
El aire es en esencia una mezcla de gases cuya constitución porcentual en volumen de algunos de sus componentes es 78% de {N}_{2} , 21% de {O}_{2} y un 1% de otros gases entre los cuales se haya el C{O}_{2} .
En este sentido, los principales componentes del océano de aire en el que nos desenvolvemos es nitrógeno y oxígeno. La respuesta correcta es la opción B.
Reactivo 29
¿Cuál de las siguientes reacciones químicas favorece la formación de la lluvia ácida?
- NaOH\to N{a}^{+}+O{H}^{-}
- S{O}_{3}+{H}_{2}O\to {H}_{2}S{O}_{4}
- {O}_{3}+NO\to N{O}_{2}+{O}_{2}
- {N}_{2}+3{H}_{2}\to 2N{H}_{3}
Solución:
La lluvia ácida es una forma de contaminación ambiental que surge como respuesta a las actividades industriales del hombre y la emisión de gases de automóviles que funcionan con combustibles fósiles.
Se origina cuando las gotitas de agua presentes en el aire entran en contacto con compuestos químicos como el C{O}_{2} , N{O}_{2} , CO, S{O}_{3} , entre otros. Suben a la atmósfera y combinados con el {H}_{2}O dan productos ácidos como el HN{O}_{3}, {H}_{2}S{O}_{4} que caen a la tierra con las precipitaciones y causan daños graves al suelo, agua y vegetación.
El efecto se evidencia mediante la ecuación química:
S{O}_{3}+{H}_{2}O\to {H}_{2}S{O}_{4}
En donde se forma ácido sulfúrico, un compuesto perjudicial para los suelos y diferentes ecosistemas. La respuesta correcta es la opción B.
Reactivo 30
Los triglicéridos son un grupo de lípidos caracterizados por tener el grupo funcional
- Éter.
- Éster.
- Amida.
- Alcohol.
Solución:
El triacilglicerol es una molécula de glicerol combinada químicamente con tres ácidos grasos unidos mediante enlace éster. Es el lípido más abundante entre los seres vivos, su función de almacenamiento energético se traduce a un metabolismo que libera más energía que la proporcionada por los carbohidratos. El músculo esquelético en reposo y el corazón utilizan como fuente de energía los ácidos grasos.
La respuesta correcta es la opción B.
Reactivo 31
Son los dos grupos funcionales presentes en todos los aminoácidos
- -COO-y-CON{H}_{2}
- -CHO y-CON{H}_{2}
- -CO-y-N{H}_{2}
- -COOH y-N{H}_{2}
Solución:
Todos los aminoácidos poseen una amina y un grupo carboxilo en su estructura. De hecho, su nombre deriva de la combinación de una amina y el ácido carboxílico, se corresponde con la opción D.
-COOH y-N{H}_{2}
Los aminoácidos son los eslabones de la cadena que conforman a las proteínas. Son moléculas de gran importancia en los seres vivos.
Reactivo 32
Calcular el valor de entalpía de la siguiente reacción:
2Zn{S}_{\left(s\right)}+3{O}_{2 \left(g\right)}\to 2Zn{O}_{\left(s\right)}+2S{O}_{2 \left(g\right)}
Considera:
∆H°ZnS=-202.9 kJ ∆H°ZnO=-348 kJ ∆H°S{O}_{2}=-296.4 kJ ∆H°{O}_{2}=0 kJ- -883 kJ
- 883 kJ
- 1230 kJ
- -1230 kJ
Solución:
La entalpía, simbolizada por la letra H, es el contenido calórico de una especie química. Su medición se realiza a través de las variaciones energéticas producidas en un proceso, puesto que su medición directa no es posible.
∆H= ∆{H}_{formación \left(productos\right)}- ∆{H}_{formación \left(reactantes\right)}
Dada la reacción balanceada:
2Zn{S}_{\left(s\right)}+3{O}_{2 \left(g\right)}\to 2Zn{O}_{\left(s\right)}+2S{O}_{2 \left(g\right)}
Procedemos a sustituir los valores que nos brinda el enunciado en la fórmula:
∆H= \left[\left(2\times -348\right)+\left(2\times -296.4\right)\right]-\left[\left(2\times -202.9\right)+\left(3\times 0\right)\right]
∆H=\left(-696-592.8\right)-\left(-405.8\right)
∆H=-\mathrm{1,288.8}+405.8
∆H=-883 kJ
La respuesta correcta es la opción A.
Reactivo 33
A presión estándar el carbono grafito es más estable que el carbono diamante. Para la transición C grafito \to C diamante se cumple que
- ∆G°<0
- ∆G°>0
- ∆G°\le 0
- ∆G°=0
Solución:
Tanto el grafito que se utiliza para escribir y el diamante, el material de las joyas preciosas; están hechos de carbono. Pero, ¿Cuál es la diferencia entre ambos? Resulta que en el diamante los átomos de carbono están perfectamente ordenados y unidos mediante enlaces covalentes en todas las direcciones, ya que es una piedra preciosa que se formó bajo mucha presión lo que hizo que adquirieran dicha disposición.
En el grafito los átomos de carbono se organizan en láminas o capas con uniones débiles unas entre otras, lo que facilita su desgaste a la hora de escribir.
Cuando se habla de una transición de grafito a carbono se necesita aplicar entre 180,000 y 200,000 veces la presión atmosférica sobre el grafito para convertirlo en diamante; esto se traduce a aplicar una gran cantidad de energía libre de Gibbs, por lo que debe ser mayor a cero (∆G°>0) .
La respuesta correcta es la opción B.
Reactivo 34
De acuerdo con su posición en la tabla periódica, ¿Cuántos electrones tiene el átomo de carbono en su segundo nivel de energía?
- Dos.
- Cuatro.
- Ocho.
- Seis.
Solución:
Como el carbono es un elemento del grupo IVA puede compartir cuatro electrones de valencia y formar cuatro enlaces covalentes fuertes. La respuesta correcta es la opción B.
Reactivo 35
¿Cuál de los siguientes compuestos es un ácido carboxílico?
Solución:
Los ácidos carboxílicos contienen al grupo carboxilo, — COOH, como su grupo funcional; el cual resulta de la combinación de un grupo carbonilo y un grupo hidroxilo. La fórmula general de un ácido carboxílico es R — COOH y la podemos observar en el compuesto:
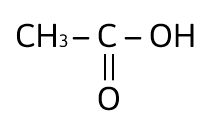
La respuesta correcta es la opción A.