Una de las principales razones de preocupación de todos los jóvenes aspirantes a estudiar en el Instituto Politécnico Nacional, es ser capaces de llevar a cabo el examen de admisión y lograr una puntuación adecuada para ser admitidos en la carrera de sus sueños.

Por eso, sabemos que quieres prepararte bien, lo que implica practicar ejercicios de cada una de las áreas que componen esta prueba.
De esta manera, no sólo serás capaz de empezar a familiarizarte con los temas que encontrarás en tu examen, sino que también podrás incrementarás tus posibilidades de lograr un buen puntaje y ser admitido en la carrera a la que apliques. Para dar el primer paso en la dirección correcta, te invitamos a ver nuestros ejercicios resueltos en este post.
¿Qué viene en el examen del IPN?
En caso de que no lo sepas, ten presente que el Instituto Politécnico Nacional comprende un examen de admisión dividido en dos etapas. La primera de ellas consiste en una serie de preguntas de comunicación y matemáticas. Seguidamente, se da paso a reactivos de ciencias como Física, Química y Biología.
Así, esta prueba se compone de un total de 130 preguntas, las cuales están distribuidas en cada una de las áreas antes mencionadas siguiendo el siguiente orden:
- 50 preguntas de matemáticas.
- 40 preguntas de comunicación.
- 10 preguntas de biología.
- 15 preguntas de química.
- 15 preguntas de física.
Ahora que tienes esto en mente, te invitamos a ver la primera parte de nuestra guía resuelta del IPN con reactivos de química para el área de Ciencias Médico Biológicas:
Ejercicio 1: Compuestos químicos
Relacionar el compuesto con la función química:
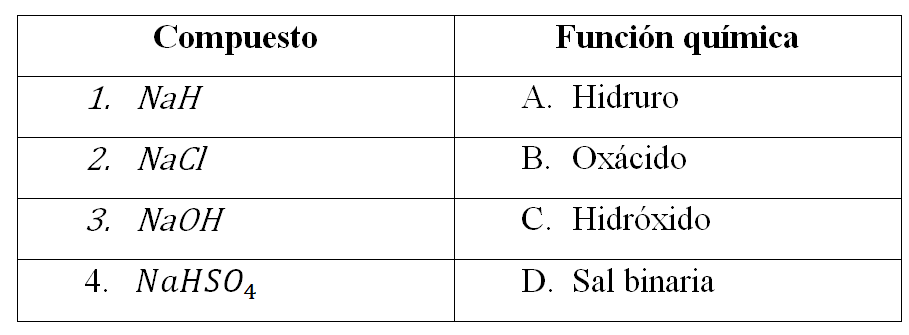
- 1A, 2B, 3C, 4D
- 1A, 2D, 3C, 4B
- 1C, 2A, 3B, 4D
- 1C, 2D, 3A, 4B
Solución:
Para relacionar el apareamiento correspondiente entre las columnas se debe tener presente lo siguiente:
- Los hidruros son compuestos constituidos por la combinación de un átomo metálico con el hidrógeno. En la columna de los compuestos el Na es un elemento metálico combinado con el H, por lo tanto la relación es 1A
- Las sales binarias son aquellas que se forman por la unión de un elemento metálico y uno no metálico y son llamadas sales haloideas aquellas que no contienen oxígeno. Estas últimas se pueden formar por la reacción entre un metal y un halógeno. En este caso el cloruro de sodio (NaCl) es el ejemplo perfecto de una sal binaria, la relación sería 2D
- Los hidróxidos se encuentran formados por la unión covalente del O y el H. Cuando reacciona un metal activo con agua se forma una base (-OH) y se libera el gas hidrógeno. En este caso el NaOH es un hidróxido. La relación es 3C
- Un compuesto oxácido o sal ácida son aquellos que forma disoluciones acuosas ácidas. Se evidencian gracias a la presencia del H. En este caso el es un oxácido por lo tanto la relación sería 4B
El análisis indica que las relaciones son:
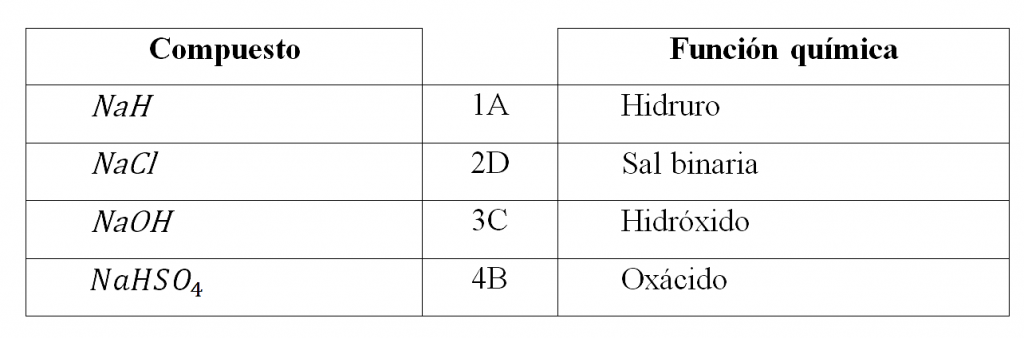
La opción correcta es la B.
Ejercicio 2: Subniveles de energía
En los grupos IA y IIA se encuentran los elementos que pertenecen al subnivel:
- s
- p
- d
- f
Solución:
Los elementos buscan su configuración más estable a través de dos vías alternativas, la pérdida o la ganancia de electrones. Los subniveles s, p, d, f… compuestos por orbitales atómicos, definen la distribución de la densidad electrónica de cada elemento, estableciendo un número específico de electrones en cada subnivel.
El subnivel s acepta un número máximo de dos electrones, por lo tanto, los elementos del grupo IA al tener un solo electrón en su última capa, pertenecen al subnivel s y los elementos del grupo IIA poseen dos electrones en su última capa de energía y también pertenecen al subnivel s.
La respuesta correcta es la opción A.
[wpipa id=»6649″]Ejercicio 3: Niveles de energía
Las letras n, m, l, s indican las características de los electrones de los átomos, por lo cual se les conoce como números:
- de masas atómicas
- de orbitales
- de niveles
- cuánticos
Solución:
Para hallar la respuesta correcta es importante tener presente la teoría:
Los números cuánticos se encargan de definir la función de onda \Psi asociada a cada electrón de un átomo: el principal “n”, el secundario “l”, magnético “m” y de spin “s”.
Los tres primeros resultan de la ecuación de onda la cual es una medida de la probabilidad de encontrar al electrón en un cierto espacio, en la cual el área de mayor valor se denomina orbital. Y el último resulta de las observaciones realizadas en los campos magnéticos generados por el mismo átomo.
En base a ello la respuesta correcta es la opción D.
Ejercicio 4: Números de oxidación de los elementos
Es el número de oxidación negativo de los elementos del grupo VI A:
- 1-
- 2-
- 3-
- 4-
Solución:
El grupo VI A también es conocido como el grupo del oxígeno. Está conformado por los elementos oxígeno (O), azufre (S), selenio (Se), telurio (Te) y polonio (Po). El número de oxidación negativo con el que suelen formar compuestos químicos es 2-.
En este sentido la respuesta correcta es la opción B.
Ejercicio 5: Distribución electrónica
Propiedad que permite determinar la polaridad del enlace:
- Resonancia
- Radio atómico
- Electronegatividad
- Afinidad electrónica
Solución:
Para comprender la solución del enunciado es importante analizar:
Cuando se forma un enlace covalente, los átomos que participan comparten sus electrones. En algunos casos, como en la molécula de \mathrm{O}_{2} los electrones se distribuyen de forma equitativa por ambos átomos. Pero, en compuestos como el HF se observa un comportamiento desigual en cuanto a la distribución electrónica. Los electrones se ven agrupados hacia el F en mayor proporción. Lo que origina un enlace covalente polar.
Esto hace que nazca la interrogante ¿Por qué los electrones son atraídos con mayor fuerza hacia un polo de la molécula?
La respuesta se halla en la electronegatividad, la cual es la capacidad de un átomo para atraer hacia sí los electrones que participan en el enlace químico. De esta manera algunos átomos, como por ejemplo los halógenos, tienen una mayor fuerza de atracción de electrones hacia sí mismos. Los elementos más electronegativos se dice que tienen gran afinidad electrónica (porque toman los electrones de otros átomos fácilmente) y alta energía de ionización (conserva sus electrones y es muy difícil que los pierda cuando se combina con otros elementos).
En base al análisis expuesto se concluye que la respuesta correcta es la opción C.
Ejercicio 6: Números de oxidación
Ordenar los anhídridos de forma ascendente de acuerdo al número de oxidación del nitrógeno:
- \mathrm{N}_{2} \mathrm{O}_{5}
- \mathrm{N}_{2} \mathrm{O}_{2}
- \mathrm{N}_{2} \mathrm{O}_{3}
- \mathrm{N}_{2} \mathrm{O}_{4}
- 1, 2, 3, 4
- 2, 3, 4, 1
- 2, 4, 1, 3
- 1, 4, 2, 3
Solución:
Los números de oxidación con los que el nitrógeno está trabajando en cada reacción presente entre las opciones es: 5+, 2+, 3+, y 4+.
Recuerda que: cuando los elementos se combinan intercambian el número de oxidación, por ejemplo:
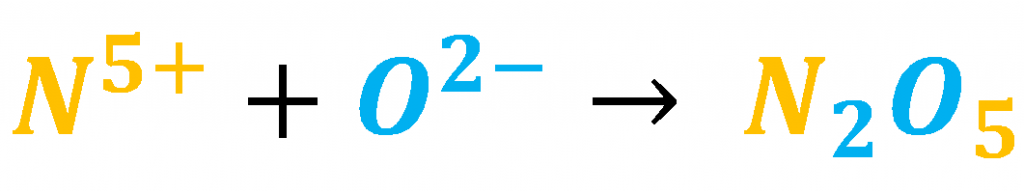
De esta manera el subíndice que se encuentra junto al oxígeno será nuestra guía para ordenar de forma ascendente los compuestos:
- \mathrm{N}_{2} \mathrm{O}_{2} (2)
- \mathrm{N}_{2} \mathrm{O}_{3} (3)
- \mathrm{N}_{2} \mathrm{O}_{4} (4)
- \mathrm{N}_{2} \mathrm{O}_{5} (1)
Así es la lista ascendente de los anhídridos siguiendo el número de oxidación del nitrógeno, por lo tanto la opción correcta es la B.
Ejercicio 7: Los elementos
Relacionar los nombres con los símbolos correspondientes:
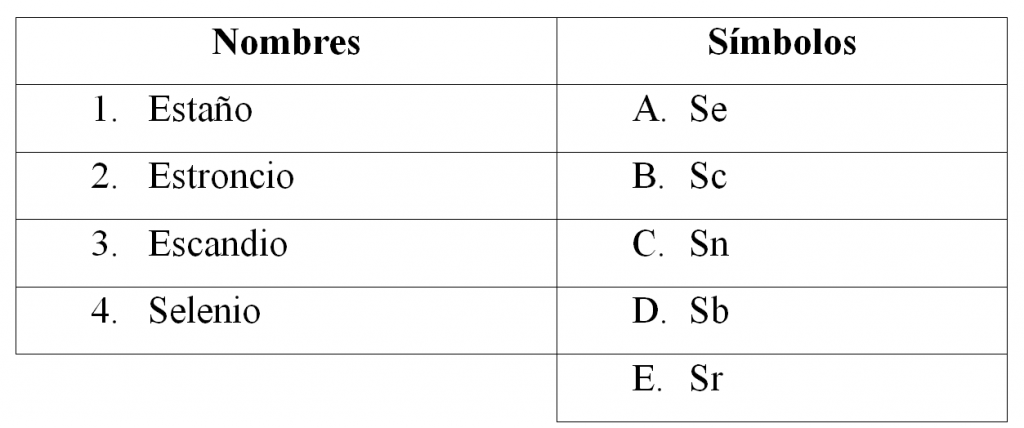
- 1A, 2B, 3D, 4C
- 1D, 2B, 3A, 4E
- 1C, 2E, 3B, 4A
- 1E, 2C, 3B, 4A
Solución:
Un elemento químico es una sustancia que no se puede descomponer en otras más simples a través de procedimientos físicos y químicos ordinarios. En la tabla periódica se encuentran todos los elementos químicos y se representan por una letra mayúscula seguida de una minúscula.
Para resolver el ejercicio se procede a hacer la relación:
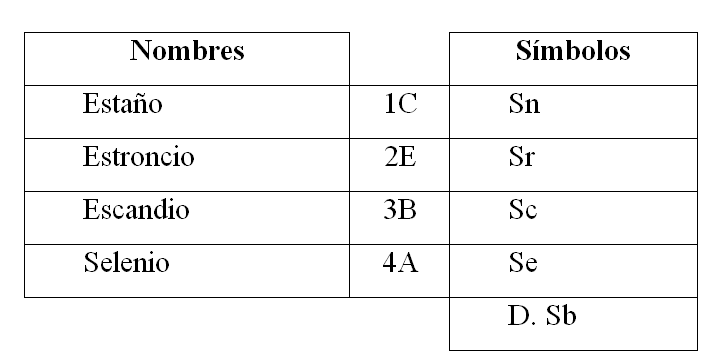
La opción correcta es la C.
Ejercicio 8: Compuestos químicos
El óxido de aluminio es un compuesto químico que se utiliza para hacer utensilios de cocina como sartenes y refractarios ¿Cuál es la fórmula de dicho óxido?
- \mathrm{AlO}_{3}
- \mathrm{Al}_{2} \mathrm{O}
- \mathrm{Al}_{2} \mathrm{O}_{3}
- \mathrm{Al}_{3} \mathrm{O}_{2}
Solución:
Primero se debe tener en cuenta los números de oxidación de los elementos, el aluminio trabaja con el número de oxidación 3+ y el oxígeno 2-. Por lo tanto, al formarse el compuesto los números de oxidación se intercambian y el óxido de aluminio tiene la fórmula: \mathrm{Al}_{2} \mathrm{O}_{3} siendo la C la opción correcta.
Ejercicio 9: Grupos funcionales
La función química hidróxido, tiene a ___________ como grupo funcional que la identifica.
- H^{+1}
- N M^{-1}
- (O H)^{-1}
- (N M O)^{-1}
Solución:
Los hidróxidos o hidroxilos están representados por la fuerte unión que existe entre el oxígeno y el hidrógeno (O H)^{-1} . El radical oxidrilo presenta valencia -1 y al combinarse con otros elementos mantiene cierta independencia del conjunto global.
La opción correcta es la C.
Ejercicio 10: Compuestos químicos
Relacionar las dos columnas:

- 1A, 2B, 3C, 4D
- 1A, 2C, 3B, 4D
- 1C, 2D, 3B, 4A
- 1C, 2B, 3A, 4D
Solución:
Para realizar el apareamiento identificamos las funciones químicas:
- Los ácidos oxácidos son aquellos que están constituidos por un anión (que contiene el oxígeno unido fuertemente a otro elemento) el hidrógeno como catión. En la tabla el oxácido se corresponde con el ácido sulfúrico \mathrm{H}_{2} \mathrm{SO}_{4} . La relación sería 1C
- Los hidruros son compuestos constituidos por la combinación de un átomo metálico con hidrógeno. El compuesto que cumple con estas características es el \mathrm{FeH}_{2} en el cual se observa la unión del hierro (un elemento metálico) con el H. La relación es 2D
- Los hidróxidos se encuentran formados por la unión covalente del O y el H. Cuando reacciona un metal activo con agua se forma una base (-OH) y se libera el gas hidrógeno. Por lo tanto, el compuesto con estas características es el \mathrm{Cu}(\mathrm{OH})_{2} y la relación sería 3B
- Las sales binarias son aquellas que se forman por la unión de un elemento metálico y uno no metálico y son llamadas sales haloideas aquellas que no contienen oxígeno. Entre los compuestos el \text { AlBr }_{3} esta constituido por la unión de un metal (aluminio) con un halógeno o no metal (bromo) por lo que se considera una sal binaria o sal haloidea. A relación es la siguiente 4A
Siguiendo el orden analítico las relaciones son las siguientes: 1C, 2D, 3B, 4A y la respuesta correcta es la opción C.
Ejercicio 11: Compuestos químicos
Relacionar el nombre común con la fórmula condensada del compuesto:

- 1A, 2B, 3C, 4D
- 1B, 2C, 3D, 4A
- 1B, 2D, 3A, 4C
- 1A, 2D, 3B, 4C
Solución:
Para relacionar el nombre común con la fórmula condensada de un compuesto se debe tomar el subíndice como guía, ya que es quien determina la cantidad de moléculas del elemento mediante la enumeración: mono, di, tri, tetra…
- Dióxido de carbono, la nomenclatura nos indica que hay dos oxígenos (dióxido) unidos a un carbono. En la columna de fórmulas condensadas el compuesto que cumple con el nombre común es el \mathrm{CO}_{2} . La relación es 1B
- Dióxido de nitrógeno, igual que el caso anterior, presencia de dos oxígenos y un nitrógeno, la fórmula correspondiente es \mathrm{NO}_{2} la relación será 2C
- Monóxido de carbono, en este caso hay un átomo de carbono unido a un átomo de oxígeno, la fórmula condensada es CO por lo tanto la relación es 3D
- Monóxido de dinitrógeno en este compuesto hay un átomo de oxígeno unidos a dos átomos de hidrógeno, la fórmula se constituye N_{2} O la relación es 4A
El apareamiento es 1B, 2C, 3D y 4A por lo tanto la opción correcta es la B.
[wpipa id=»6866″]Ejercicio 12: Soluciones
Este tipo de soluciones son capaces de mantener su pH en valores aproximadamente constantes, aun cuando se agreguen pequeñas cantidades de ácido o base, o se diluya la solución. Además, se caracterizan por contener simultáneamente una especie débil y su par conjugado.
- Diluida
- Saturada
- Amortiguadora
- Sobresaturada
Solución:
Las soluciones amortiguadoras son aquellas capaces de mantener el pH de una disolución, están conformadas por un ácido o base débil que en soluciones acuosas no están completamente disociados y dependiendo del grado de acidez o basicidad de la solución son capaces de amortiguar los cambios de pH liberando o aceptando protones.
Por ejemplo, el pH de la sangre debe ser de 7,4 para que se mantengan las funciones fisiológicas, los aminoácidos son especies amortiguadoras o buffers porque tienen COOH y \mathrm{NH}_{3} en su estructura y la histidina en particular tiene un pKa cercano al pH sanguíneo, por lo tanto se encarga de mantener las condiciones constantes dentro del organismo sin variaciones de pH que puedan desnaturalizar proteínas y alterar las actividades enzimáticas.
La definición y el ejemplo nos permiten evaluar que la opción C es la correcta dentro del ejercicio.


