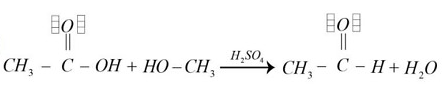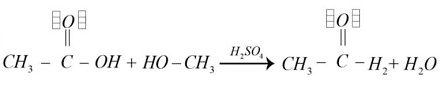En este tutorial resolvemos la parte 3 de la guía del IPN correspondiente al área de química para Ingeniería y Cs Físico-Matemáticas. No olvides consultar todos los tutoriales sobre la guía del IPN.

Recuerda que el examen del IPN cuenta con 130 preguntas. Por esta razón, debes enfocarte en comprender las diferentes áreas de conocimiento que deberás enfrentar en este examen. No olvides lo importante que es lograr un puntaje igual o superior al mínimo requerido para la carrera de tu interés.
¡No pierdas la oportunidad de ganarte tu puesto como estudiante del IPN, empieza a prepararte ya mismo!
¿Qué viene en el examen del IPN?
Por si no lo sabes, el examen de admisión del Instituto Politécnico Nacional está separada en dos partes distintas. La primera de ellas, corresponde a preguntas de lengua y matemáticas. Seguidamente, darás paso a la resolución de reactivos de áreas específicas como Química, Biología y Física.
Así, la cantidad de reactivos de cada área está distribuida de la siguiente forma:
- 50 preguntas de matemáticas.
- 40 preguntas de comunicación.
- 10 preguntas de biología.
- 15 preguntas de química.
- 15 preguntas de física.
Ahora, damos paso a desglosar los ejercicios resueltos de esta tercera y última parte de nuestra guía resuelta de reactivos de química:
Ejercicio 25: Energía
Para producir ozono se requiere de O_{2} y energía solar. Para que ambos se combinen se necesita de:
- Catalizador
- Tiempo de reacción
- Energía de reacción
- Energía de activación
Solución:
Para que se produzca el ozono se necesita de longitudes de onda inferiores a los 241 nm (energía de activación) que tengan la capacidad de romper las moléculas de O_{2} para que se forme oxígeno atómico O y este se combine con otras moléculas de O_{2} para formar el O_{3} . Lo que quiere decir que se necesitan longitudes de onda muy cortas y con mayor energía para permitir el proceso de formación de ozono.
En base al análisis la opción correcta es la D
Ejercicio 26: Estequiometría
Es el proceso que describe las etapas de transformación de reactivos a productos:
- Reacción química
- Reacción covalente
- Mecanismo de reacción
- Mecanismo de propagación
Solución:
Una reacción química es un proceso en el que una o varias sustancias se transforman. El proceso que brinda una descripción detallada de la transformación de los reactivos a productos es el mecanismo de reacción. La opción correcta es la C.
Ejercicio 27: Entalpía
En la ecuación C H_{3} O H(l)+\frac{3}{2} O_{2} \rightarrow C O_{2}(g)+H_{2} O(l) el calor de reacción tiene un valor de -726.63 kj. Lo que indica que esta cantidad calorífica es ________ por el sistema.
- Irradiada
- Absorbida
- Producida
- Conducida
Solución:
La teoría dice que cuando el \Delta \mathrm{H} tiene un valor negativo, el contenido calórico de los productos es menor que el contenido calórico de los reactantes y se genera una reacción exotérmica que produce calor.
Verificamos que en efecto el valor del \Delta \mathrm{H} es -726.63 KJ lo que indica que la cantidad calorífica es producida por el sistema. La opción C es la correcta.
Ejercicio 28: Ley de los gases
La ecuación V=\frac{k}{P} a temperatura constante, corresponde a la ley de:
- Boyle
- Dalton
- Charles
- Mariotte
Solución:
La relación V=\frac{k}{P} establece que la presión de una cantidad fija de un gas a temperatura constante es inversamente proporcional al volumen del gas, lo que se conoce como Ley de Boyle. La respuesta correcta es la A.
Ejercicio 29: Leyes de los gases
La ley general de los gases engloba la ley de Boyle-Mariotte, la ley de Chales y la ley de Gay-Lussac. En todas ellas se establece el comportamiento de los gases respecto a las variables de:
- Presión, temperatura y volumen
- Densidad, temperatura y volumen
- Concentración, presión y volumen
- Presión de vapor, fluidez y comprensibilidad
Solución:
El comportamiento macroscópico de las sustancias gaseosas ha tenido gran relevancia dentro del desarrollo de la teoría atómica de la materia y la teoría cinética molecular de los gases. Las leyes que norman el comportamiento de los gases evalúan las variables de presión temperatura y volumen, cuando se controlan las variables de presión y temperatura es fácil predecir la actuación de un gas.
En base a la teoría la opción correcta es la A.
Ejercicio 30: Compuestos orgánicos: ácidos carboxílicos
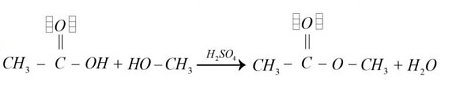
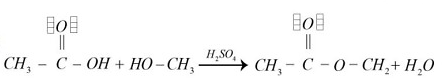
Identificar la reacción de esterificación que se realiza a partir de un ácido carboxílico y un alcohol los cuales se disocian en un éster y agua
Solución:
Para conocer la respuesta se debe comprender el proceso de esterificación, el cual es simplemente la conversión de un ácido carboxílico en un éster. El efecto neto de la esterificación es la sustitución de un grupo ―OH por un grupo ―OR’. Los ácidos carboxílicos no son los suficientemente reactivos como para experimentar directamente la adición nucleofílica, pero su reactividad se eleva cuando se somete a la presencia de un ácido fuerte como el HCl o el \mathrm{H}_{2} \mathrm{SO}_{4} .
Al hacer reaccionar el ácido carboxílico con un alcohol se fomenta la formación del éster, mientras mayor sea la cantidad de alcohol presente más favorecida se ve la síntesis. El enlace C―OH del ácido carboxílico es el que se rompe en la reacción para dar lugar al C―OR´. El resultado de la esterificación es un éster más agua
En base a ello, se pueden analizar los componentes que deben estar presentes para la esterificación entre las opciones:
- Verifica que se trata de un ácido carboxílico reaccionando con un alcohol, en presencia de un ácido fuerte ( \mathrm{H}_{2} \mathrm{SO}_{4} ), que genera éster y agua
- Las opciones c y d no generan productos de interés
- En la opción B “aparentemente” se genera un éster, pero al revisar con detalle el carbono del enlace O-C H_{2} no tiene sus cuatro electrones enlazados (como debería) por lo tanto también descartamos esta opción
- La opción A cumple con el proceso de esterificación, se forma un éster y agua. Por lo tanto, es la opción correcta
Ejercicio 31: Leyes de los gases
La siguiente aseveración: “Se compone de partículas puntuales que se mueven de un modo aleatorio y no interaccionan entre sí, no presentan fuerzas de atracción o repulsión entre sus moléculas, no presentan cambios de estado y siempre ocupan el mismo volumen en las mismas condiciones de presión y temperatura” corresponde a un:
- Gas real
- Gas ideal
- Sólido amorfo
- Sólido cristalino
Solución:
La aseveración habla de un gas ideal, porque las partículas de los gases reales interactúan eléctricamente entre ellas, la densidad no es uniforme y se presentan cambios de estado cuando se extrae o aplica energía a la sustancia gaseosa. Por lo tanto la opción correcta es la B.
Ejercicio 32: Entalpía
La ecuación termoquímica C_{3} H_{5} O H(l)+3 O_{2}(g) \rightarrow 2 C O_{2}(g)+3 H_{2} O(l) presenta un valor de \Delta \mathrm{H} de -795.6 KJ, por lo que el tipo de calor y de reacción que le corresponde son:
- \Delta \mathrm{H} formación y reacción exotérmica
- \Delta \mathrm{H} formación y reacción endotérmica
- \Delta \mathrm{H} combustión y reacción exotérmica
- \Delta \mathrm{H} combustión y reacción endotérmica
Solución:
Teóricamente la entalpía de combustión ( \Delta \mathrm{H} combustión) es la variación del contenido calórico que se genera al combinar 1 mol de sustancia con el oxígeno a temperatura y presión constante. Así mismo, las reacciones exotérmicas tienen un \Delta \mathrm{H} = – y liberan calor al medio.
C_{3} H_{5} O H(l)+3 O_{2}(g) \rightarrow 2 C O_{2}(g)+3 H_{2} O(l)
En la ecuación termoquímica se visualiza que 1 mol de una especie química (en este caso C_{3} H_{5} O H ) está reaccionando con el oxígeno y la variación del contenido calórico tiene un valor negativo, por lo tanto el sistema produce calor (reacción exotérmica).
Entonces se está en presencia de un \Delta \mathrm{H} combustión de reacción exotérmica. La opción correcta es la C.
Ejercicio 33: Ley de los gases
“A temperatura constante, el volumen ocupado por una cantidad definida de gas varia en forma inversamente proporcional a la presión absoluta ejercida sobre él.” Este enunciado corresponde a la ley:
- Dalton
- Charles
- Gay-Lussac
- Boyle-Mariotte
Solución:
El enunciado del ejercicio corresponde a la ley de Boyle-Mariotte. Lo que quiere decir que si el volumen de un gas aumenta, la presión disminuye y si el volumen disminuye la presión aumenta. La opción correcta es la D.
Ejercicio 34: Entalpía
Para el sistema mostrado a continuación, la ( \Delta \mathrm{H}^{\circ} reacción) está dada por la expresión:
\mathrm{CS2}(\mathrm{l})+3 \mathrm{O}_{2}(\mathrm{~g}) \rightarrow \mathrm{CO}_{2}(\mathrm{~g})+2 \mathrm{SO}_{2}(\mathrm{~g})
- \Delta \mathrm{H}^{\circ} \text { reacción }=\Delta \mathrm{H}^{\circ} \mathrm{f} \mathrm{CS}_{2}+\Delta \mathrm{H}^{\circ} \mathrm{O} \mathrm{O}_{2}-\Delta \mathrm{H}^{\circ} \mathrm{f} \mathrm{SO}_{2}
- \Delta \mathrm{H}^{\circ} \text { reacción }=\Delta \mathrm{H}^{\circ} \mathrm{f} \mathrm{CO}_{2}+2 \Delta \mathrm{H}^{\circ} \mathrm{S} \mathrm{SO}_{2}-3 \Delta \mathrm{H}^{\circ} \mathrm{f} \mathrm{O}_{2}-\Delta \mathrm{H}^{\circ} \mathrm{f} \mathrm{CS}_{2}
- \Delta \mathrm{H}^{\circ} \text { reacción }=\Delta \mathrm{H}^{\circ} \mathrm{f} \mathrm{CS}_{2}+3 \triangle \mathrm{H}^{\circ} \mathrm{f} \mathrm{O}_{2}-\Delta \mathrm{H}^{\circ} \mathrm{f} \mathrm{CO} 2-2 \Delta \mathrm{H}^{\circ} \mathrm{f} \mathrm{SO}_{2}
- \Delta \mathrm{H}^{\circ} \text { reacción }=\Delta \mathrm{H}^{\circ} \mathrm{f} \mathrm{CO}_{2}+2 \Delta \mathrm{H}^{\circ} \mathrm{f} \mathrm{SO}_{2}-\left(\Delta \mathrm{H}^{\circ} \mathrm{f} \mathrm{O}_{2}+\Delta \mathrm{H}^{\circ} \mathrm{f} \mathrm{CS}_{2}\right)
Solución:
En este caso se debe comprender que para un sistema termodinámico la variación de la entalpía (\Delta \mathrm{H}) es una magnitud extensiva, es decir, es proporcional a la cantidad de producto generado. Su valor se obtiene con las diferencias de las entalpías contenidas en los productos y los reactantes. Las unidades con las que trabaja con el Joule/mol y calorías/mol.
\Delta \mathrm{H}=\mathrm{H} \text { productos }-\mathrm{H} \text { reactantes }
De allí parte la fórmula:
\Delta \mathrm{H}^{\circ} \text { reacción }=\text { Suma } \Delta \mathrm{H}^{\circ} \text { formación (productos) }-\text { Suma } \Delta \mathrm{H}^{\circ} \text { formación (reactantes) }
Se realiza cada sumatoria con la reacción:
\mathrm{CS} 2(\mathrm{l})+3 \mathrm{O}_{2}(\mathrm{~g}) \rightarrow \mathrm{CO}_{2}(\mathrm{~g})+2 \mathrm{SO}_{2}(\mathrm{~g})
Sustituyendo:
\text { Suma } \Delta H^{\circ} \text { formación (productos) }=\Delta H^{\circ} \mathrm{f} \mathrm{CO}_{2}+2 \mathrm{AH}^{\circ} \mathrm{L} \mathrm{SO}_{2}
\text { Suma } \Delta H^{\circ} \text { formación (reactantes) }=\Delta H^{\circ} \mathrm{f} \mathrm{CS}_{2}+3 \mathrm{dH}^{\circ} \mathrm{f} \mathrm{O}_{2}
\Delta \mathrm{H}^{\circ} \text { reacción }=\Delta \mathrm{H}^{\circ} \mathrm{f} \mathrm{CO}_{2}+2 \Delta \mathrm{H}^{\circ} \mathrm{f} \mathrm{SO}_{2}-\Delta \mathrm{H}^{\circ} \mathrm{f} \mathrm{CS}_{2}+3 \Delta \mathrm{H}^{\circ} \mathrm{f} \mathrm{O}_{2}
\Delta \mathrm{H}^{\circ} \text { reacción }=\Delta \mathrm{H}^{\circ} \mathrm{f} \mathrm{CO}_{2}+2 \Delta \mathrm{H}^{\circ} \mathrm{f} \mathrm{SO}_{2}-3 \Delta \mathrm{H}^{\circ} \mathrm{f} \mathrm{O}_{2}-\Delta \mathrm{H}^{\circ} \mathrm{f} \mathrm{CS}_{2}
En base a ello la respuesta correcta es la opción B. En dicha respuesta podemos observar que el 3 \mathrm{H}^{\circ} \mathrm{f} \mathrm{O}_{2} se encuentra antes que el \Delta \mathrm{H}^{\circ} \mathrm{f} \mathrm{CS}_{2} (área de los reactantes) esto es posible por la propiedad conmutativa de la suma.
Ejercicio 35: Reacciones químicas
El ____________ se presenta cuando los cambios de velocidad de reacción en ambos sentidos son ___________, permaneciendo constantes las concentraciones.
- Pero equivalente – iguales
- Volumen molar – diferentes
- Equilibrio químico – iguales
- Equilibrio químico – diferentes
Solución:
El equilibrio químico es un estado en el que no se observa cambio neto alguno de una sustancia en particular. Por lo tanto, El equilibrio químico se presenta cuando los cambios de velocidad de reacción en ambos sentidos son iguales, permaneciendo constantes las concentraciones. La opción correcta es la C.