¡Continuamos aspirante! Vamos a resolver la cuarta parte del simulacro de física del examen de ingreso al IPN por el área de Ciencias Sociales y Administrativas, desde el 31 al 40.

Continuamos con los siguientes 10 reactivos del simulacro de física, para la prueba de ingreso al Instituto Politécnico Nacional en el área de Ciencias Sociales y Administrativas.
Estudia bien los conceptos que aparecen en el temario. Al resolver problemas de física, las leyes y fundamentos serán tu principal herramienta para llegar a la solución.
Reactivo 31
La solubilidad, es una propiedad ________ de los materiales que cuantifica la cantidad de soluto que se puede disolver a una determinada temperatura.
- Absoluta
- Relativa
- Intensiva
- Extensiva
Solución:
Como sabemos, la materia se describe mediante ciertas propiedades que podemos medir de forma directa en el laboratorio o de forma indirecta a través de experimentos.
Las propiedades físicas de la materia se clasifican en dos grandes grupos: intensivas y extensivas. Una propiedad es intensiva cuando no depende de la cantidad de masa y las extensivas dependen explícitamente de la cantidad de masa.
Propiedades intensivas son: la densidad, el punto de fusión, el punto de ebullición y la solubilidad, mientras que las extensivas pueden ser: la masa, el peso, el volumen y la porosidad.
Teniendo en cuenta todo el análisis anterior y la frase incompleta del enunciado, concluimos que la respuesta correcta se encuentra en el inciso c).
Reactivo 32
A partir del siguiente enunciado, indique la ley de la termodinámica que permitiría encontrar una respuesta.
Se tienen tres objetos, de tal forma que A se encuentra en equilibrio térmico con C y, a su vez, C se encuentra en equilibrio térmico con B . ¿Cuál es la situación para la interacción entre A y B ?
- Ley de los gases
- Ley cero
- Primera Ley
- Segunda Ley
Solución:
Recordemos que la termodinámica define como equilibrio térmico a la situación en la que dos sistemas no intercambian energía en forma de calor o radiación electromagnética.
Previo al estado de equilibrio, uno de los cuerpos se encontraba a mayor temperatura que el otro, esto lo conocemos también como un gradiente de temperatura, de tal forma que el objeto menos caliente absorbe calor del objeto más caliente, hasta que ambos igualan sus temperaturas y cesa el intercambio de calor.
Lo que hemos descrito antes se conoce como la ley cero de la termodinámica y nos permitiría responder la pregunta del enunciado. Aunque no es necesario indicarlo, debemos saber que A y B se encuentran también en equilibrio por consecuencia de la ley cero.
Concluimos que la respuesta es el inciso b).
Reactivo 33
¿Cuánto serian 450 Kelvin en grados Fahrenheit?
- 350 °F
- 450 °F
- 300 °F
- 255 °F
Solución:
Para convertir de Kelvin a Fahrenheit, utilizamos la siguiente relación matemática:
\mathrm{F}=\frac{9}{5}\times \left(\mathrm{K}-273.15\right)+32
Sustituimos en la ecuación.
\mathrm{F}=\frac{9}{5}\times \left(450-273.15\right)+32
\mathrm{F}=350.33\mathrm{ }°\mathrm{F}
Comparando nuestro resultado, concluimos indicando como correcta la opción a).
Reactivo 34
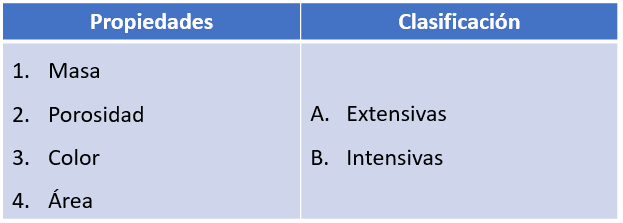
Relacione las propiedades de la materia que se indican en la columna izquierda con la clasificación de la columna derecha.
- 14A y 23B
- 24A y 13B
- 124A y 3B
- 3A y 124B
Solución:
Antes de responder a la pregunta, recordemos rápidamente el significado de propiedad intensiva y propiedad extensiva.
Una propiedad es intensiva cuando no depende de la cantidad de materia que posee un objeto, de forma contraria, una propiedad es extensiva cuando el valor medido depende de la masa. Teniendo en cuenta esto, pasemos a parear cada propiedad de la tabla.
Masa: la masa es, por definición, la cantidad de materia que posee un cuerpo, por tanto, es extensiva: 1A.
Porosidad: se define como el espacio relativo entre las partículas de un material, es una propiedad extensiva: 2A.
Color: el color de un objeto depende del conjunto de frecuencias de radiación electromagnética que su superficie es capaz de reflejar, por ende, no depende de la cantidad de materia que tenga el cuerpo, es una propiedad intensiva: 3B.
Área: corresponde a la superficie externa de un objeto, mientras más grande sea mayor será el área que ocupe su capa externa. Es una propiedad extensiva: 4A.
Uniendo todas las soluciones nos queda: 124A y 3B.
Comparando con los incisos, concluimos que la respuesta correcta es el c).
Reactivo 35
Cuando decimos que un proceso termodinámico es isotérmico, decimos principalmente que su _______ permanece constante.
- Masa
- Presión
- Temperatura
- Volumen
Solución:
Esta pregunta es totalmente teórica y, en caso de haber olvidado el significado de isotérmico, podemos siempre analizar el término en cuestión. El prefijo iso según la real academia española de la lengua significa igual, mientras que térmico hace referencia a la temperatura de un cuerpo.
Sintetizando lo anterior, concluimos que un sistema isotérmico es aquel que permanece con la misma temperatura. La respuesta es el inciso c).
Reactivo 36
Dados dos estados 1 y 2 de un sistema termodinámico en el que se estudia un gas considerado ideal, demuestre la ecuación que relaciona ambos estados cuando la presión permanece constante.
- \frac{{V}_{1}}{{T}_{1}}=\frac{{V}_{2}}{{T}_{2}}
- \frac{{T}_{1}}{{V}_{1}}=\frac{{T}_{2}}{{V}_{2}}
- \frac{{V}_{1}}{{T}_{1}}=-\frac{{V}_{2}}{{T}_{2}}
- \frac{{T}_{1}}{{V}_{1}}=\frac{{V}_{2}}{{T}_{2}}
Solución:
Primero, recordemos la ecuación de estado para los gases ideales:
\frac{PV}{T}=k
Donde k es una constante. Si identificamos la presión, el volumen y la temperatura para cada estado nos queda:
\mathrm{E}\mathrm{s}\mathrm{t}\mathrm{a}\mathrm{d}\mathrm{o}\mathrm{ }1:\mathrm{ }\frac{{P}_{1}{V}_{1}}{{T}_{1}}=k
\mathrm{E}\mathrm{s}\mathrm{t}\mathrm{a}\mathrm{d}\mathrm{o}\mathrm{ }2:\mathrm{ }\frac{{P}_{2}{V}_{2}}{{T}_{2}}=k
Debido a que la k es una constante, podemos igualar a partir de ella ambos estados el gas.
\frac{{P}_{1}{V}_{1}}{{T}_{1}}=\frac{{P}_{2}{V}_{2}}{{T}_{2}}
Ya que la presión es constante durante todo el proceso, la podemos simplificar de la igualdad.
\frac{{V}_{1}}{{T}_{1}}=\frac{{V}_{2}}{{T}_{2}}
Esta es la ecuación que relaciona dos estados de un gas que permanece a temperatura constante.
Comparando con los incisos, concluimos que la respuesta correcta es el a).
Reactivo 37
Calcula el trabajo realizado por un gas que permanece a presión constante de 55 kPa, si tiene un volumen inicial de 0.001 {\mathrm{m}}^{3} a 250 K y luego incrementa su temperatura a 435 K.
- 20.7 \mathrm{J}
- 30.7 \mathrm{J}
- 40.7 \mathrm{J}
- 50.7 \mathrm{J}
Solución:
La ecuación para calcular el trabajo por un gas a presión constante, utilizamos la siguiente ecuación.
W=P\left({V}_{2}-{V}_{1}\right)
El ejercicio nos indica la presión y el primer volumen, debemos calcular el volumen en el estado 2. Empleamos la siguiente ecuación relacionada con los gases ideales sometidos a proceso isobáricos:
\frac{{V}_{1}}{{T}_{1}}=\frac{{V}_{2}}{{T}_{2}}
Despejamos el volumen {V}_{2} .
{V}_{2}=\frac{{T}_{2}}{{T}_{1}}{V}_{1}
Sustituimos los datos dados.
{V}_{2}=\frac{435 \mathrm{K}}{250 \mathrm{K}}\left(0.001 {\mathrm{m}}^{3}\right)=0.00174 {\mathrm{m}}^{3}
Calculamos el trabajo realizado:
W=55 \mathrm{k}\mathrm{P}\mathrm{a}\left(0.00174-0.001\right)=40.7 \mathrm{J}
El sistema realizó 40.7 Joules de trabajo mecánico.
La respuesta correcta está en el inciso c).
Reactivo 38
Calcule el volumen que ocupa una sustancia que marca en el densímetro digital una densidad de 1455 \mathrm{k}\mathrm{g}/{\mathrm{m}}^{3} , si previamente se ha medido su masa en una balanza, arrojando un resultado de 450 gramos.
- 0.0031 {\mathrm{m}}^{3}
- 0.00031 {\mathrm{m}}^{3}
- 0.000031 {\mathrm{m}}^{3}
- 0.031 {\mathrm{m}}^{3}
Solución:
Recordemos la ecuación para calcular la densidad de una sustancia:
\rho =\frac{m}{V}
En este caso tenemos la densidad \rho y la masa, despejamos el volumen.
V=\frac{m}{\rho }
Sustituimos los valores en \mathrm{k}\mathrm{g} y {\mathrm{m}}^{3} .
V=\frac{0.45 \mathrm{k}\mathrm{g}}{1455 \mathrm{k}\mathrm{g}/{\mathrm{m}}^{3}}=0.00031 {\mathrm{m}}^{3}
La sustancia ocupa un volumen de 0.00031 metros cúbicos.
Comparando con los incisos, concluimos que la respuesta correcta es el b).
Reactivo 39
Determine la eficiencia de un sistema termodinámico que absorbe 2400 Joules de calor de una fuente y produce 1000 Joules de trabajo mecánico para impulsar carga pesada.
- 31.66\%
- 41.66\%
- 21.66\%
- 51.66\%
Solución:
En termodinámica y en casi todas las ciencias, la eficiencia de un sistema de calcula como el cociente entre lo que sale sobre lo que entra, en este caso, del sistema sale energía en forma de trabajo y entra energía en forma de calor.
n=\frac{{W}_{neto}}{{Q}_{abs}}*100
Sustituimos los valores dados:
n=\frac{1000 \mathrm{J}}{2400 \mathrm{J}}*100=41.66\%
El sistema tiene una eficiencia del 41.66%.
La respuesta correcta está en el inciso b).
Reactivo 40
Se define como el punto triple del agua a la temperatura y presión en la que conviven…
- El estado gaseoso y líquido a la vez
- El estado gaseoso y sólido a la vez
- El estado líquido y sólido a la vez
- El estado líquido, sólido y gaseoso a la vez
Solución:
En termodinámica, se conoce como punto triple del agua a la combinación de presión y temperatura en la que coexisten en equilibrio térmico la fase líquida, sólida (hielo) y gaseosa del agua. Teniendo en cuenta esto, concluimos que el inciso que completa la frase es el d).
Se define como el punto triple del agua a la temperatura y presión en la que conviven el estado líquido, sólido y gaseoso a la vez.


