¡Hola de nuevo aspirante! Esta vez, vamos a resolver los ejercicios de química para la guía de ingreso UAM para la división de Ciencias Biológicas y de la Salud, compuesta por un total de 16 reactivos, desde el 95 hasta el 110.

La guía contiene muy pocos reactivos en comparación a la extensión del temario. Te recomiendo continuar practicando una vez hayas desarrollado estos ejercicios.
Te dejo por acá un resumen de la convocatoria UAM con los datos mas resaltantes del examen.
- Número de convocatorias: Dos al año.
- Fechas de registro: marzo y agosto del 2022
- Oferta académica: 82 carreras
- Divisiones académicas: 6
- Modalidad: en línea
Estructura del examen de ingreso UAM 2022
El examen de ingreso está dividido en dos grandes partes:
- Prueba de aptitud
- Prueba de conocimientos específicos
La prueba de aptitud, con preguntas sobre Razonamiento Matemático y Razonamiento Verbal, tiene una extensión total de 40 reactivos que se reparten equitativamente entre ambas temáticas.
La de conocimientos específicos, depende de la división a la que pertenezca tu carrera. En el caso de Ciencias Biológicas y de la Salud, las asignaturas correspondientes son: química, biología y física.
El siguiente, es un resumen de los temas que abarcan cada una de las asignaturas mencionadas anteriormente.
Química
- Química general
- Química inorgánica
- Química orgánica
Biología
- Evolución
- Bioquímica
- Citología
- Genética
- Histología
- Anatomía y fisiología
- Diversidad de organismos
- Ecología
- Educación para la salud
Física
- Estándares de medición
- Cinemática
- Dinámica
- Termodinámica
- Electromagnetismo
- Óptica
Resumen de reactivos en cada parte del examen.
| Área | Reactivos | Porcentaje |
|---|---|---|
| Razonamiento verbal | 20 | 25% |
| Razonamiento matemático | 20 | 25% |
| Conocimientos específicos | 40 | 50% |
| Total | 80 | 100% |
Temario de Química para CBS
El siguiente, es un desglose exacto de las sub ramas de química que van para el examen de Ciencias Biológicas y de la Salud.
Química general
- Modelos atómicos.
- Orbitales atómicos.
- Tabla periódica.
- Tipos de enlaces.
Química inorgánica
- Nomenclatura.
- Equilibrio ácidobase.
- Sistemas redox.
- Estequiometria.
Química orgánica
- Nomenclatura.
- Grupos funcionales.
- Enlaces del carbono con: hidrógeno, oxígeno, nitrógeno, fósforo y azufre.
Guía UAM CBS Química
Finalmente, pasamos con el desarrollo paso a paso y con tips calve, de los ejercicios de química para CBS en la UAM. No olvides visitar nuestro canal de youtube, ahí encontrarás contenido audiovisual que te ayudará en tu preparación para el examen de admisión.
Reactivo 95: Átomos, moléculas y iones
La unidad individual más pequeña de un compuesto químico que conserva sus propiedades es:
- La molécula
- El elemento
- La mezcla
- El átomo
- El mineral
Solución:
Una molécula es un agregado de, por lo menos, dos átomos en un arreglo definido que se mantienen unidos a través de fuerzas químicas (también llamadas enlaces químicos). Puede contener átomos del mismo elemento o átomos de dos o más elementos, siempre en una proporción fija, de acuerdo con la ley de las proporciones definidas. Y representa la unidad individual más pequeña de un compuesto.
En dicho sentido, la respuesta correcta es la opción A.
Reactivo 96: Ley de conservación de la materia
La ley de la conservación de la materia establece que la materia se conserva en:
- Procesos adiabáticos únicamente.
- Procesos isotérmicos únicamente.
- Sistemas cerrados únicamente.
- Sistemas abiertos únicamente.
- Cualquier proceso y en cualquier sistema.
Solución:
La ley de la conservación de la materia o ley de conservación de la masa. Fue un estudio cuantitativo de Lavoisier (1743 – 17941), ya que en su época prevalecía la teoría del flogisto o principio según el cual los cuerpos poseen la capacidad de inflamarse; los experimentos llevados a cabo por Lavoisier fueron cruciales para el abandono de dicho principio.
Gracias a sus innumerables estudios sobre reacciones de combustión y calentamiento de metales, los resultados obtenidos le permitieron proponer que la masa inicial de los reaccionantes no variaba en la masa final de los productos, es decir, los cambios de las sustancias no producían la creación o destrucción de la materia sino sólo su reordenamiento. Generalizando sus experimentos pudo concluir que, en un sistema cerrado la cantidad de materia permanece constante.
Por ejemplo, la conservación de los recursos naturales se basa en dicha ley por lo que es fácil asociarla a los ciclos biogeoquímicos, en el que los elementos pueden formar nuevas sustancias que circulan a través del planeta y luego retornan a su origen.
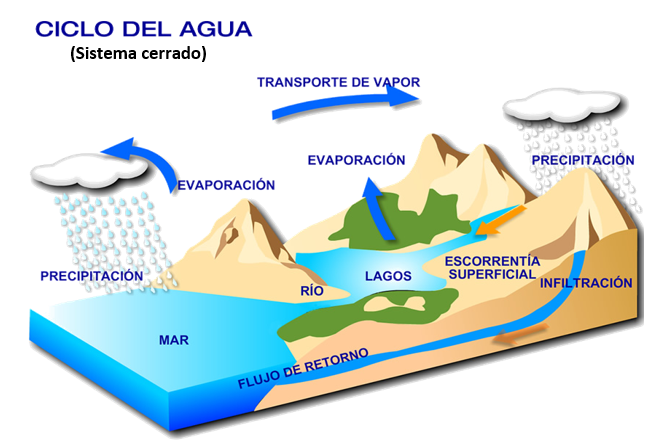
La respuesta correcta es la opción C.
Reactivo 97: Estructura atómica
Los números cuánticos se simbolizan con las letras:
- K,L,M,N
- n,l,s,p
- s,p,d,f
- n,l,m,s
- k,l,m,n
Solución:
Los números cuánticos son parámetros asociados a magnitudes numéricas que ayudan a determinar la distribución de los electrones en un átomo.
Los números cuánticos nos ayudan a entender la forma en que se distribuyen los electrones en los orbitales atómicos. Se basan en la teoría cuántica que considera que el átomo presenta un núcleo atómico formado por protones y neutrones y los electrones se encuentran rodeándolo en niveles de energía específicos, describiendo trayectorias definidas, con una orientación determinada y los electrones girando además sobre su propio eje.
Son los siguientes:
- Número cuántico principal se representa con la letra “n”.
- Número cuántico secundario se representa con la letra “l”.
- Número cuántico magnético se representa con la letra “m”.
- Número cuántico spin se representa con la letra “s”.
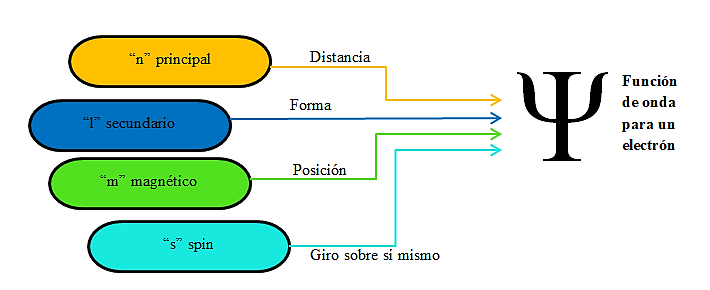
La respuesta correcta es la opción D.
Reactivo 98: Distribución electrónica
El número de electrones que el azufre ( {S}^{16} ) tiene en su capa externa (de valencia) es:
- 14
- 16
- 6
- 4
- 8
Solución:
Para conocer el número de electrones que posee el azufre en capa de valencia debemos establecer la distribución electrónica del elemento.
Como el número atómico es Z = 16 para el S, debemos rellenar cada subnivel energético hasta llegar al valor indicado:
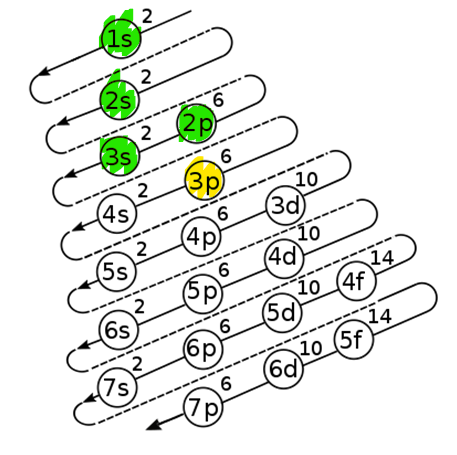
La estructura electrónica para el azufre Z = 16 es:
1{s}^{2}
2{s}^{2} 2{p}^{6}
3{s}^{2} 3{p}^{4}
Posee 6 e- en su capa de valencia, por lo tanto, cuando se combina busca rodearse de 8 e-.
La respuesta correcta es la opción C.
Reactivo 99: Compuestos químicos
Si reacciona un no metal con oxígeno se obtiene un:
- Epóxido
- Hidróxido
- Anhídrido
- Ácido
- Dióxido
Solución:
Los óxidos ácidos o anhídridos son compuestos que están constituidos por un elemento con características no metálicas y el oxígeno. Los dos elementos presentan características análogas, pertenecen al grupo de los no metales. Sin embargo, la presencia del oxígeno altera el carácter del elemento vecino debido al enorme poder de atracción que presenta hacia los electrones.
La respuesta correcta es la opción C.
Reactivo 100: Compuestos químicos
¿En cuál de los siguientes compuestos el nitrógeno tiene valencia +3?
- {N}_{2}O
- {N}_{2}{O}_{3}
- NO
- {N}_{2}{O}_{5}
- {N}_{2}{O}_{4}
Solución:
Cuando los elementos se combinan intercambian sus valencias y lo refleja el siguiente compuesto:

Podemos comprobarlo si al sumar los números de oxidación el resultado es cero:
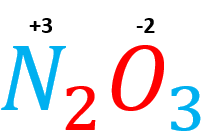
\left(+3\bullet 2\right)= +6
\left(-2 \bullet 3\right)= -6
-6+6=0
Con esto hemos verificado que, en dicho compuesto, el nitrógeno trabaja con valencia +3.
La respuesta correcta es la opción B.
Reactivo 101: Compuestos químicos
Los átomos en los compuestos se mantienen unidos por:
- Polaridad
- Electronegatividad
- Valencia
- Enlaces
- Energía
Solución:
Cuando los átomos reaccionan para formar compuestos se genera una fuerza de atracción que los mantiene unidos. Esta fuerza se llama enlace químico y varía en su naturaleza. El enlace químico ocurre entre los electrones de la última capa de los elementos que se combinan, llamados electrones de valencia, los cuales están más alejados del núcleo atómico y por tanto están más sujetos a alteraciones al entrar en contacto con otros electrones de valencia de átomos combinantes.
La respuesta correcta es la opción D.
Reactivo 102: Enlaces covalentes
El máximo número de enlaces covalentes que puede formar el fósforo ( {P}^{15} ) es:
- 5
- 0
- 1
- 3
- 9
Solución:
La configuración electrónica del fósforo es: 1{s}^{2} 2{s}^{2} 2{p}^{6} 3{s}^{2} 3{p}^{3}
Aunque tiene 5 e- de valencia y busca rodearse de 8 para alcanzar su configuración de gas noble, se puede pensar que establece un máximo de 3 enlaces covalentes. Pero no, el fósforo es un elemento que forma parte del periodo 3, lo que le otorga la capacidad de establecer un octeto expandido, entendiéndose como un elemento que tiene la capacidad de poseer más de 8 electrones en su última capa.
De esta manera el fósforo puede establecer un máximo de 5 enlaces covalentes, ejemplo de ello es el pentafluoruro de fósforo ( P{F}_{5}) .
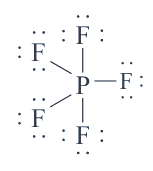
En la estructura de Lewis del pentafluoruro de fósforo se puede apreciar como el P tiene 10 electrones de valencia a su alrededor.
La respuesta correcta es la opción A.
Reactivo 103: Compuestos químicos
La fórmula química del bisulfito de sodio es:
- NaHS{O}_{4}
- N{a}_{2}S
- N{a}_{2}S{O}_{3}
- N{a}_{2}S{O}_{4}
- NaHS{O}_{3}
Solución:
El bisulfito de sodio es un compuesto que lleva por fórmula química NaHS{O}_{3} es un compuesto muy inestable y se utiliza en la industria de alimentos, farmacéutica, como colorante, entre otros. La respuesta correcta es la opción B.
Reactivo 104: Ácidos y bases
La sustancia que cede electrones es:
- Ácido de Brönsted-Lowry.
- Electrolito.
- Ácido de Lewis.
- Base de Lewis.
- Base de Brönsted-Lowry.
Solución:
En 1932, el químico norteamericano G. N. Lewis formuló una definición. Postuló lo que actualmente se denomina una base de Lewis como una sustancia que puede donar un par de electrones. Un ácido de Lewis es una sustancia capaz de aceptar un par de electrones.
En este sentido la respuesta correcta es la opción D.
Reactivo 105: Ecuación química
Los subíndices que aparecen en una fórmula química indican composición en:
- Masa
- Volumen
- Moles
- Peso
- Densidad
Solución:
Los subíndices que aparecen en una fórmula química señalan los moles del elemento:
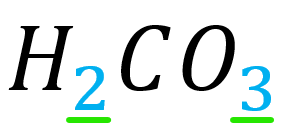
La respuesta correcta es la opción C.
Reactivo 106: Estequiometría
En 0.75 moles de etano hay ____ gramos:
- 45
- 5
- 75
- 4
- 30
Solución:
Primero debemos conocer la masa molar del etano ( {C}_{2}{H}_{6} ):
\left(12 g/mol\bullet 2\right)+\left(1g/mol\bullet 6\right)=30 g/mol
Establecemos la relación matemática con el siguiente análisis:
Si 1 mol de etano contiene 30 g/mol ¿Cuántos gramos hay en 0.75 moles?
g {C}_{2}{H}_{6}=0.75 moles {C}_{2}{H}_{6} \bullet \frac{30 g {C}_{2}{H}_{6}}{1 mol {C}_{2}{H}_{6} }=22.5 g
En 0.75 moles de etano hay 22.5 gramos. La respuesta correcta es la opción B.
Reactivo 107: Óxido – reducción
En la reacción:
KMn{O}_{4}+KCl+{H}_{2}S{O}_{4} \to MnS{O}_{4}+{K}_{2}S{O}_{4}+C{l}_{2}+{H}_{2}OEl elemento que se reduce es el:
- Cloro.
- Manganeso.
- Potasio.
- Azufre.
- Oxígeno.
Solución:
El cambio en los números de oxidación de los elementos antes y después de la reacción se denomina reacción Redox.
Existen consideraciones importantes para este tema, como:
- Algunos elementos ganan electrones y su número de oxidación disminuye, por lo tanto, se dice que se
- Otros elementos de la misma reacción pueden perder electrones y su número de oxidación aumenta, en este caso se
Por lo tanto:
- Oxidación: ↑Aumento del número de oxidación ↓pérdida de electrones
- Reducción: ↓ disminución del número de oxidación ↑ ganancia de electrones
Agente oxidante: Es el reactante que tiene el elemento que se reduce
Agente reductor: Reactante que tiene el elemento que se oxida
Con las consideraciones anteriores, podemos evaluar el estado de oxidación – reducción de los elementos que participan en la reacción utilizando los números de oxidación
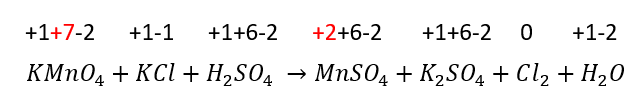
En la distribución de los números de oxidación antes y después de la reacción, el manganeso es el elemento que está ganando 5 electrones, por lo tanto, se reduce.
La respuesta correcta es la opción B.
Reactivo 108: Óxido – reducción
Cuando un elemento se oxida:
- Gana electrones.
- Pierde electrones.
- Pierde neutrones.
- Gana protones.
- Pierde protones.
Solución:
Cómo se habló en el reactivo anterior, los elementos que pierden electrones se oxidan durante la reacción redox.
La respuesta correcta es la opción B.
Reactivo 109: Compuestos orgánicos
Compuesto orgánico en el que todos los carbonos tienen hibridación s{p}^{2}
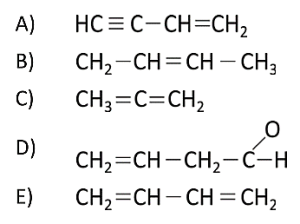
Solución:
La hibridación s{p}^{2} es el resultado de la combinación de un orbital s con dos orbitales p. Tiene una geometría triangular plana, ya que los ángulos de enlace están ubicados a 120° uno de otro. Son los enlaces dobles.
Entre las opciones que nos brinda el enunciado, podríamos aludir que la respuesta correcta es: C{H}_{3}=C=C{H}_{2} porque sólo hay enlaces dobles, pero al mirar con detalle, se hace evidente que el compuesto orgánico está mal escrito, ya que el primer carbono no puede establecer 5 enlaces como indica su unión a los 3 hidrógenos y el doble enlace con el C vecino.
Por ende, la siguiente opción que corresponde es la que posee el compuesto:
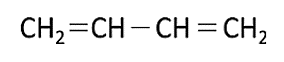
La respuesta correcta es la opción E.
Reactivo 110: Alcoholes
Por deshidratación de dos alcoholes se obtiene:
- Un ácido.
- Una cetona.
- Un éster.
- Un éter.
- Un aldehído.
Solución:
La deshidratación de alcoholes secundarios produce su oxidación a cetonas.
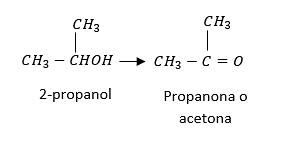
La respuesta correcta es la opción B.


