Resuelve la versión final del examen simulador de química del área de Ingeniería y Cs. Físico Matemáticas.

¡Muy buen trabajo! Has llegado a la quinta y última versión de la serie de exámenes simulacro de química del área IyCFM del IPN, los cuales son una herramienta efectiva para mejorar tus habilidades a la hora de presentar la prueba de ingreso a la universidad.
Te recuerdo que has realizado 75 reactivos de química similares a los de tu prueba de admisión del poderosísimo IPN.
Te felicito por tu constancia y dedicación, ahora tienes un conocimiento nuevo que puedes aprovechar para alcanzar tu cupo en la carrera de tus sueños.
Reactivo 1
El elemento _____________ se usa como combustible nuclear, fuente de energía nuclear y de elementos radiactivos, como el radio.
- Polonio.
- Uranio.
- Actinio.
- Francio.
Solución:
El uranio es el elemento de mayor peso atómico en la naturaleza. Debido a su elevada reactividad, no se encuentra de forma libre si no junto a óxidos, arseniatos, silicatos, fosfatos y carbonatos. El uso más importante de este elemento es en la industria nuclear, se utiliza como combustible de reactores nucleares para producir energía eléctrica. Sin embargo, también tienen aplicaciones en el diagnóstico de enfermedades, tratamiento de alimentos, insecticida, entre otros.
Respuesta correcta opción B.
Reactivo 2
La química experimental comenzó a desarrollarse con fuerza a partir del siglo XIX, gracias a _______________ al proponer la primera teoría atómica.
- Rutherford.
- Robert Boyle.
- John Dalton.
- Joseph Priestley.
Solución:
La teoría atómica de Dalton fue la columna vertebral de la química moderna. En sus investigaciones aseveró que los elementos están formados por partículas diminutas, indivisibles e indestructibles llamados átomos. Dichos átomos son iguales para un mismo elemento, pero tienen diferentes propiedades entre elementos distintos. Su teoría dio paso a una nueva visión de cómo estaba formada la materia.
Respuesta correcta opción C.
Reactivo 3
Relacione las fórmulas condensadas con el grupo de hidrocarburo al que pertenece:

- 1A, 2D, 3C, 4B
- 1C, 2A, 3D, 4B
- 1A, 2D, 3B, 4C
- 1C, 2D, 3A, 4B
Solución:
Para establecer las relaciones sin cometer ningún error puedes dibujar la estructura y de allí conocer el hidrocarburo al que hace referencia.
Comencemos con el la fórmula semidesarrollada es . Por lo tanto, se trata de un alqueno. Relación 2D.
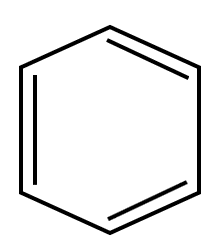
Sigue el , indiscutiblemente la fórmula habla de un benceno o compuesto aromático. Relación 4B.
El metano es un alcano, formado únicamente por enlaces sencillos en su estructura. Relación 1C.
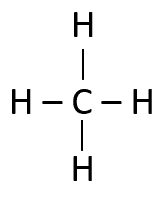
Metano
Por último, tenemos al su fórmula semidesarrollada es un compuesto que pertenece al grupo de los alquinos. Relación 3A.
Respuesta correcta opción D.
Reactivo 4
Seleccione la reacción que indique la precipitación del cloruro de plata
Solución:
La formación de precipitado en una ecuación química se representa con el símbolo . La reacción:
Indica la formación de un precipitado de cloruro de plata.
Respuesta correcta opción B.
Reactivo 5
Calcular el peso molecular (g/mol) del considerando las masas atómicas (g/mol): Pb = 207; Cl = 35.5
- 349 g/mol
- 239 g/mol
- 247 g/mol
- 298 g/mol
Solución:
Para conocer el peso molecular del tetracloruro de plomo o cloruro de plomo (IV), debemos multiplicar la cantidad de átomos presentes en el compuesto por su masa atómica y luego sumar todos los resultados:
Plomo:
Cloro:
PM del
Respuesta correcta opción A.
Reactivo 6
Calcular la masa en kg del cloruro de plata producido al utilizar 90 kg de cloruro de sodio con un 70% de pureza, de acuerdo con la siguiente ecuación:
PM (g/mol):
- 154 Kg
- 145.4 Kg
- 134.5 Kg
- 130 Kg
Solución:
Para conocer la masa de cloruro de plata formada, primero debemos calcular la masa pura de cloruro de sodio:
Si en 100 Kg de hay 70 Kg puros. En 90 Kg de cloruro de sodio ¿Cuántos Kg puros hay?
Masa de AgCl a partir de 63 Kg puros de .
Teniendo en cuenta los pesos moleculares de las sustancias, según la reacción:
Sabemos que 58.5 g de cloruro de sodio producen 143.3 g de cloruro de plata ¿Cuántos gramos de cloruro de plata se producirán con 63 Kg de NaCl?
Para conocer la masa en Kg, transformamos
- 5 g de
- 3 g de AgCl = 0.1433 Kg de AgCl
La relación matemática es:
Se producen 154 Kg de al utilizar 90 Kg de con un 70% de pureza.
Respuesta correcta opción A.
Reactivo 7
Seleccione la función faltante en el recuadro:
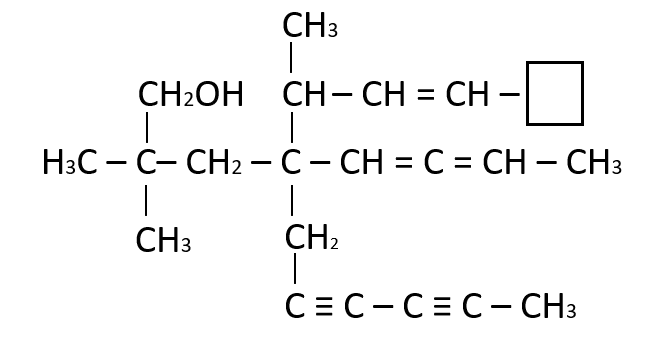
- C
Solución:
La función faltante es un , ya que el carbono comparte un enlace con el vecino y necesita tres hidrógenos para completar sus cuatro enlaces.
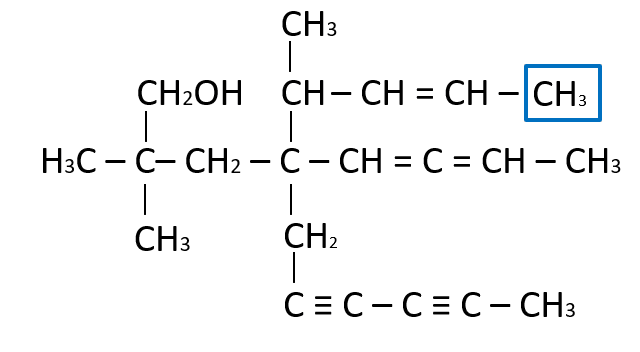
Respuesta correcta opción D.
Reactivo 8
Identificar el tipo de función química en el siguiente compuesto orgánico:

- Alcano
- Éster
- Alqueno
- Aldehído
Solución:
El compuesto que presenta el enunciado mediante una fórmula taquigráfica se refiere a un alqueno de seis carbonos. Su característica principal es el doble enlace.
Respuesta correcta opción C.
Reactivo 9
Señale el tipo de ruptura generada en el siguiente esquema:
![]()
- Iónica.
- Heterolítica.
- Por sustitución.
- Homolítica.
Solución:
La ruptura homolítica es la separación de un enlace en la que cada átomo conserva uno de los dos electrones del enlace. Como lo demuestra la ecuación del enunciado.
Respuesta correcta opción D.
Reactivo 10
Identificar el tipo de reacción química que se lleva a cabo en la siguiente ecuación:
- Halogenación.
- Solvatación.
- Combustión.
- Síntesis de un alcano.
Solución:
La reacción química que ocurre es una combustión, ya que reúne todas las características:
- Reacciona el etano (un combustible excelente) con oxígeno (el comburente).
- Se produce
- Hay una liberación de calor, es decir, es una reacción exotérmica.
Respuesta correcta opción C:
Reactivo 11
Nombre del compuesto principal generado en la siguiente reacción química:
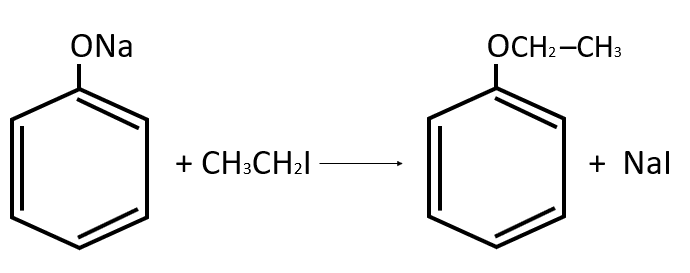
- Fenil etil éter
- Fenóxido de sodio
- Cloruro de sodio
- Benzoato de sodio.
Solución:
El compuesto principal es el del anillo bencénico transformado en el radical fenilo, ya que uno de sus hidrógenos ha sido sustituido por un oxígeno al que se encuentra unido un radical etil o etilo. El oxígeno en el centro de ambos radicales es característico del grupo funcional éter.
Uniendo todas las características que analizamos del compuesto, el nombre del mismo es fenil etil éter
Respuesta correcta opción A.
Reactivo 12
Identificar la reacción que se presenta a continuación:
- Combustión de un alcano.
- Hidrogenación de un alqueno.
- Halogenación de un alqueno.
- Combustión de un alqueno.
Solución:
Al igual que lo demuestra la reacción del reactivo 10, estamos en presencia de una reacción de combustión. Solo que el combustible esta vez es un alqueno por su fórmula .
Respuesta correcta opción D.
Reactivo 13
Una variación del estado de un sistema físico en el cual la temperatura del sistema permanece constante se conoce como:
- Proceso adiabático.
- Proceso isocórico.
- Proceso isotérmico.
- Proceso isobárico.
Solución:
Los procesos en los que no existe variación de la temperatura se denominan isotérmicos.
Respuesta correcta opción C.
Reactivo 14
Calcular la normalidad de una solución formada por 30 g de para preparar 2 litros de solución.
PM del g/mol
- 0.405 N
- 0.305 N
- 0.512 N
- 0.600 N
Solución:
Comenzamos calculando el peso equivalente de la sustancia:
Una vez obtenido el peso equivalente se procede a calcular los equivalentes de soluto al dividir los gramos de soluto entre su peso equivalente:
Sustituimos los valores:
Una vez hallados los equivalentes y sabiendo que el volumen de la solución son dos litros, sustituimos los valores en la fórmula general:
La concentración de la solución es de 0.305 normal.
Respuesta correcta opción B.
Reactivo 15
La capacidad de los metales para conducir el calor y la electricidad se explica a partir de la teoría de______________.
- Hibridación.
- Interacciones electrostáticas.
- Capacidad conductiva.
- Orbitales moleculares.
Solución:
La capacidad de los metales para conducir el calor y la electricidad se explica a partir de la teoría de orbitales moleculares.
Respuesta correcta opción D.


