Vamos con la segunda parte del examen simulador de Química para el área de ciencias médico biológicas del examen de admisión al IPN. Para esta segunda parte vamos a resolver los ejercicios del 16 al 30.

Reactivo 16
La ____________ es un método de separación que se utiliza para separar los diferentes componentes de una mezcla en estado líquido.
- Cromatografía
- Centrifugación
- Decantación
- Destilación
Solución:
Las mezclas son una combinación de dos sustancias en diferentes proporciones en las que cada una mantiene su identidad y propiedades distintivas. Existen diferentes técnicas de separación de mezclas que se utilizan con la finalidad de:
- Identificar los componentes de una mezcla.
- Obtener sustancias puras de gran importancia.
- Eliminar las partículas no deseadas en una muestra.
La cromatografía es una técnica utilizada para separar los diferentes componentes de una mezcla líquida. La mezcla se disuelve en un fluido llamado fase móvil, que la transporta a través de una estructura que contiene otro material llamado fase estacionaria.
Respuesta correcta opción A.
Reactivo 17
Elija dos moléculas diatómicas entre los siguientes compuestos:
- HCl
- NaCl
- HN{O}_{3}
- {O}_{3}
- 1 – 3
- 2 – 4
- 1 – 2
- 3 – 3
Solución:
Las moléculas diatómicas son aquellas que están compuestas por la unión de dos átomos. En el enunciado, los compuestos que cumplen dicha cualidad son:
- El ácido clorhídrico (HCl) una molécula formada por la unión de un átomo de hidrógeno y uno de cloro.
- El cloruro de sodio (NaCl) molécula diatómica compuesta por un átomo de sodio y uno de cloro.
Respuesta correcta opción C.
Reactivo 18
Selecciones las opciones que correspondan a un par de elementos no metálicos:
- Tántalo
- Iridio
- Radón
- Argón
- Rutenio
- Tántalo – argón.
- Radón – argón.
- Rutenio – tántalo.
- Iridio – radón.
Solución:
El radón es radiactivo y el último miembro de los gases nobles, fue descubierto en el año 1900 por Frederick Dorn, un químico alemán y ayudó a comprender mejor el origen de la desintegración radiactiva y la transmutación de los elementos. Es el gas noble, conocido, más pesado.
Lord Rayleigh y Ramsay obtuvieron el Premio Nobel en 1904 por el descubrimiento del argón. Su nombre proviene del griego “argos” que significa inactivo. Es un gas noble de gran uso en la metalurgia y en las lámparas incandescentes.
Respuesta correcta opción B.
Reactivo 19
Indique el tipo de enlace que se establece en la estructura de Lewis señalada con los números 1 y 2
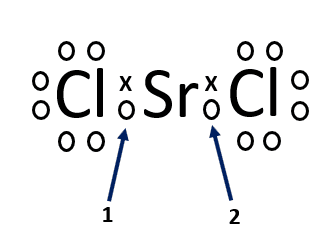
- Covalente – covalente.
- Iónico – iónico.
- Enlaces de coordinación.
- Covalente – iónico.
Solución:
El compuesto del enunciado es el cloruro de estroncio ( SrC{l}_{2}) en estado gaseoso la estructura de la molécula es lineal y establece uniones covalentes. El estroncio, por su parte, utiliza los dos orbitales híbridos sp para enlazarse a los átomos de cloro.
Respuesta correcta opción A.
Reactivo 20
En el esquema de óxido-reducción que se muestra en la reacción, indique el proceso que sufren las sustancias que participan:
3{P}_{4}+20HN{O}_{3}+8{H}_{2}O \to 12{H}_{3}P{O}_{4}+20NO

- 1AD, 2B, 3D, 4C
- 1E, 2D, 3B, 4B
- 1D, 2A, 3B, 4C
- 1A, 2D, 3B, 4A
Solución:
Para explicar el esquema de óxido-reducción que refleja el enunciado, es importante tener puntos conceptuales bien definidos como:
- Oxidación es la pérdida de electrones en un átomo o ion.
- Reducción es la ganancia de electrones en un átomo o ion.
- Agente oxidante: Es el reactante que tiene el elemento que se reduce.
- Agente reductor: Reactante que tiene el elemento que se oxida.
Para analizar los cambios producidos en los elementos durante el curso de la reacción redox debemos asignar el número de oxidación a los reactantes y productos:
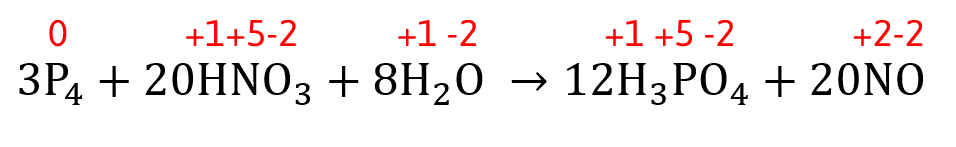
En base a ello, el análisis de la reacción es el siguiente:
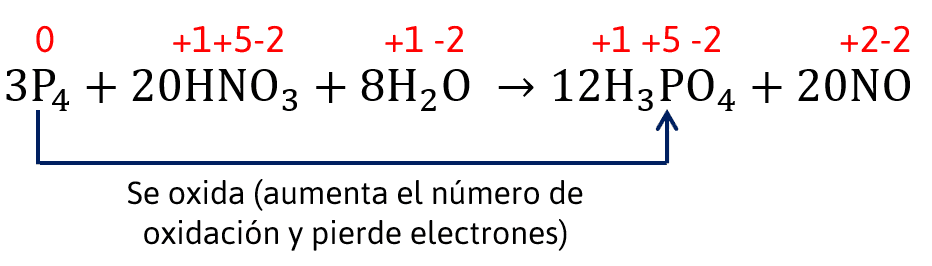

El agente oxidante es el ácido nítrico, porque es el reactante que posee el nitrógeno, es decir, el elemento que se reduce.
El agente reductor es el fósforo, ya que es el reactante que contiene al elemento que se oxida.
Respuesta correcta opción D.
Reactivo 21
El compartimiento de electrones durante un enlace químico permite a los átomos participantes buscar la estabilidad al completar el octeto de electrones en su última capa de energía para satisfacer la configuración electrónica de un gas noble.
El enunciado corresponde con:
- Regla del dueto.
- Regla del octeto.
- Ley de las proporciones múltiples.
- Ley de Dalton.
Solución:
Los átomos diferentes del hidrógeno tienden a estabilizarse al completar ocho electrones en su última capa electrónica, adquiriendo una configuración electrónica similar a la de los gases nobles, lo que se conoce como la regla del octeto.
Respuesta correcta opción B.
Reactivo 22
En las ecuaciones químicas de óxido-reducción, cuando un elemento se encuentra sin combinar, el número de valencia es:
- 0
- 1
- 2
- 3
Solución:
El número de oxidación o valencia para los elementos sin combinar, que participan en las reacciones químicas, es igual a cero.
Respuesta correcta opción A.
Reactivo 23
Calcular el porcentaje de Cl presente en el compuesto LiCl
Considere, masa atómica (g/mol): Li = 7; Cl=35.5
- 16.5 %
- 24.3 %
- 83.5 %
- 67.2 %
Solución:
Para calcular el porcentaje de cloro presente en el cloruro de litio, necesitamos conocer el peso molecular de la sustancia, en primera instancia:
PM del LiCl: (7 + 35.5) g/mol = 42.5 g/mol
Teniendo el peso molecular del compuesto, dividimos la masa atómica del elemento de interés (en este caso el Cl) entre la masa molar del compuesto y multiplicamos el resultado por 100:
\%Cl=\frac{35.5 g/mol}{42.5 g/mol}\times 100=83.5\%
\%Cl=83.5
Respuesta correcta opción C.
Reactivo 24
¿Cuál es el tipo de hibridación que presenta el metano \left(C{H}_{4}\right) entre los enlaces carbono – hidrógeno?
- sp
- s{p}^{2}-s{p}^{3}
- sp-s{p}^{2}
- {sp}^{3}
Solución:
La estructura del metano es la siguiente:
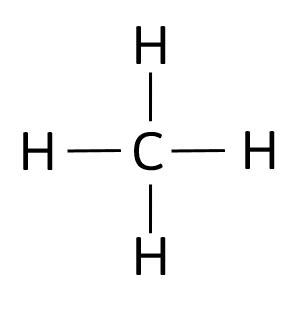
El metano está formado únicamente por enlaces sencillos entre el carbono y el hidrógeno, es decir, una hibridación {sp}^{3} .
Respuesta correcta opción D.
Reactivo 25
Identificar el nombre del siguiente compuesto:

- Butano
- Butino
- Ciclobuteno
- Ciclopenteno
Solución:
La estructura del compuesto nos indica que:
- Es un compuesto orgánico cíclico.
- Presenta un doble enlace, por lo que pertenece al grupo de los alquenos.
- Posee cuatro carbonos.
En conjunto podemos deducir que se trata de un clicloalqueno, los cuatro carbonos nos permiten identificar que el nombre del compuesto es ciclobuteno.
Respuesta correcta opción C.
Reactivo 26
La relación presión – volumen de un gas se conoce como ________________, la cual explica que existe una relación inversa entre la presión y el volumen de un gas a temperatura constante.
- Ley de Charles.
- Ley de Boyle.
- Ley de Dalton.
- Ley de Charles.
Solución:
La relación presión – volumen de un gas se conoce como ley de Boyle, la cual explica que existe una relación inversa entre la presión y el volumen de un gas a temperatura constante. En otras palabras, el volumen de una cantidad fija de un gas que se mantiene a temperatura constante es inversamente proporcional a la presión del gas.
Respuesta correcta opción B.
Reactivo 27
Si la concentración de una disolución se expresa en molaridad (M) quiere decir que existe cierto número de moles disueltos en:
- 100 ml de disolución.
- 10 dl de disolución.
- 200 ml de disolución.
- 1 l de disolución.
Solución:
La molaridad es una unidad de concentración que relaciona los moles del soluto disueltos por litro de disolución. Por lo tanto, si la concentración de una disolución se expresa en molaridad (M) quiere decir que existe cierto número de moles disueltos en 1 L de disolución.
Respuesta correcta opción D.
Reactivo 28
En una disolución sobresaturada, ¿Qué componente se encuentra en mayor cantidad?
- Solvente
- Agua
- Solución
- Soluto
Solución:
En las disoluciones sobresaturadas existe una mayor cantidad de soluto de la que el solvente pude disolver, por ello las partículas del soluto son visibles en este tipo de mezclas.
Respuesta correcta opción D.
Reactivo 29
Los procesos electroquímicos son reacciones ____________ donde la energía que libera una reacción espontánea se convierte en electricidad, o donde la energía eléctrica se aprovecha para que ocurra una reacción química no espontánea.
- Exotérmicas
- Redox
- De síntesis
- Endotérmicas
Solución:
Los procesos electroquímicos son reacciones redox donde la energía que libera una reacción espontánea se convierte en electricidad, o donde la energía eléctrica se aprovecha para que ocurra una reacción química no espontánea
Respuesta correcta opción B.
Reactivo 30
Una ____________ es un dispositivo que produce el flujo de electrones a partir de una reacción química espontánea de óxido-reducción.
- Celda galvánica.
- Fibra de vidrio.
- Electrólisis.
- Circuito cerrado.
Solución:
Una celda galvánica es un dispositivo que produce el flujo de electrones a partir de una reacción química espontánea de óxido-reducción.
Respuesta correcta opción A.

