Para comprender los cálculos químicos que te permiten determinar las masas y cantidades de diversos compuestos presentes en una reacción de interés, debes reconocer las diferencias entre peso atómico y peso molecular.
Pondremos a prueba la teoría con la resolución de un ejercicio práctico en el que debes calcular el peso molecular de un compuesto.
¿Qué es el peso atómico?
El peso atómico es la masa expresada en gramos de un mol de átomos.
En el pasado el químico investigador John Dalton logró deducir el peso de los átomos a partir de las proporciones de combinación en gramos, que se encontraban entre los diferentes elementos.

Realizó un estudio en el agua y encontró 8 gramos de oxígeno se encontraban con 1 de Hidrógeno; en el \mathrm{CO}_{2} 16 gramos de oxígeno siempre estaban con 6 gramos de Carbono; lo mismo se repetía con diferentes materiales.
Luego del análisis, Dalton asumió que los átomos reales eran muy pequeños y tomó estos valores como sus pesos relativos, es decir comparándolos con el peso de uno de ellos tomado como base, y que él escogió como el Hidrógeno. Así, logró determinar un gran número de pesos atómicos relativos.
Puedes consultar el peso atómico de cada elemento en la tabla periódica. Tomemos de muestra el aluminio para hacer una ejemplificación del legado de Dalton:
El peso atómico del Al es 27 g/mol: Esto significa que un mol de átomos de aluminio pesan 27 gramos.
¿Qué es el peso molecular?
Sencillamente se define como el peso de un mol de moléculas.
Una molécula es la suma de dos o más átomos, con propiedades químicas específicas. Si los átomos son iguales representan una molécula de un elemento químico si son diferentes, la estructura química presente es un compuesto químico.
Calcular es peso molecular
Para conocer la masa de una molécula o de un mol de moléculas se debe conocer el peso atómico de cada uno de los átomos constituyentes:
Conoce la el peso molecular o la masa de una molécula gaseosa, \mathbf{H}_{2} :
- La molécula contiene dos átomos. El subíndice indica el número de átomos presentes
- Para calcular el peso molecular, verifica el peso atómico del elemento
- El peso atómico para el elemento hidrogeno es 1 g/mol
- Multiplica el peso atómico por el número de átomos presentes
2 número de átomos x 1 g/mol peso atómico del elemento = 2 g/mol peso molecular
El peso molecular de la molecular de hidrógeno gaseoso es 2 g/mol.
Análisis: Un mol de moléculas de hidrógeno gaseoso pesa 2 gramos.
En el caso de tratarse de un compuesto químico, por contener átomos diferentes, el peso molecular debe tomar en cuenta los pesos atómicos de los elementos diferentes y sumarlos para obtener el valor del peso molecular del compuesto completo.
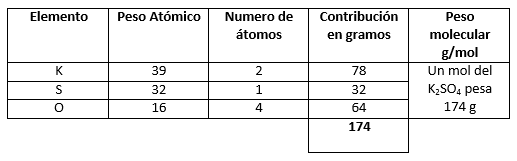
Ejemplo: calcular el peso molecular del \mathrm{K}_{2} \mathrm{SO}_{4}
Realiza el siguiente ejercicio:
Ordena las sustancias de acuerdo a su peso molecular
Ordena de manera ascendente las siguientes sustancias de acuerdo a su peso molecular:
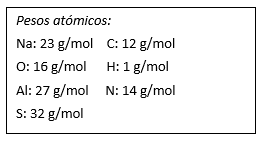
- \mathrm{SO}_{3}
- \mathrm{Al}_{2} \mathrm{O}_{3}
- \mathrm{H}_{2} \mathrm{CO}_{3}
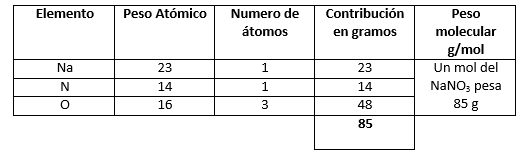
- \mathrm{NaNO}_{3}
- 4, 3, 1 ,2
- 4, 2, 3, 1
- 3, 2, 4, 1
- 3, 1, 4, 2
Aplica la teoría-practica que aprendiste:
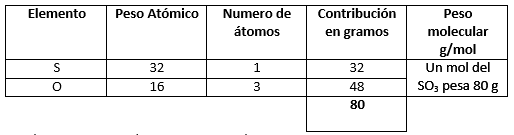
- \mathrm{SO}_{3}
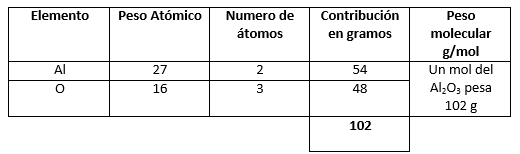
- \mathrm{Al}_{2} \mathrm{O}_{3}
- \mathrm{H}_{2} \mathrm{CO}_{3}
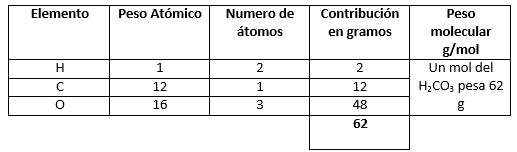
- \mathrm{NaNO}_{3}
Según los resultados el orden seria el siguiente:
- \mathrm{H}_{2} \mathrm{CO}_{3} (3)
- \mathrm{SO}_{3} (1)
- \mathrm{NaNO}_{3} (4)
- \mathrm{Al}_{2} \mathrm{O}_{3} (2)
La respuesta correcta es la opción D


