¡Hola joven aspirante! A lo largo de este tutorial, vamos a resolver los 10 reactivos del módulo de química para la UANL. Recuerda intentar resolverlos por tu cuenta antes de continuar, el puntaje que obtengas en el examen dependerá de lo preparado que estés el día de la prueba.

A continuación, un resumen de la convocatoria y del proceso de selección a la UANL:
- Períodos de ingreso: Dos al año.
- Inicio de registro: Abril y Octubre
- Carreras ofertadas: 100+
- Examen de admisión: Pearson
- Porcentaje de Aceptación: 50%
Estructura del examen de la UANL
El examen de ingreso a la Universidad Autónoma de Nuevo León está dividido en dos partes:
- La primera, corresponde a conocimientos generales.
- La segunda, a los conocimientos por área que dependerán de la carrera a la que desees ingresar.
La siguiente es una tabla, en la que puedes consultar el área, número de reactivos y el tiempo que tendrás para resolver cada parte del examen.
| Partes del examen | Áreas | Reactivos | Tiempo |
|---|---|---|---|
| Primera | Pensamiento matemático y analítico | 50 | 90 |
| Estructura de la lengua y comprensión lectora | 50 | 90 | |
| Segunda | Inglés | 20 | 20 |
| Comprensión lectora | 20 | 30 | |
| Área de conocimiento 1 | 20 | 20 | |
| Área de conocimiento 2 | 20 | 20 | |
| Totales | 180 | 270 |
La mayoría de aspirantes estudian los temas de la prueba pero olvidan un factor importante: el tiempo. Con nuestros simuladores no solo practicas con reactivos similares a los del examen, también puedes configurar el tiempo de la prueba simulacro.
Temario del Área de Química
El área de química en la segunda parte del examen, se divide en las siguientes ramas:
Estructura atómica
- El átomo: estructura (partículas subatómicas) y propiedades (número atómico y masa atómica).
- Tabla periódica: grupos y periodos, propiedades periódicas: electronegatividad, radio atómico, energía de ionización y estado de agregación.
- Propiedades físicas y químicas de metales, no metales, semimetales y gases nobles.
Enlaces químicos
- Configuración electrónica: nivel energético, orbitales atómicos, configuraciones electrónicas y electrones de valencia.
- Regla del octeto y estructura de Lewis.
- Tipos de enlaces químicos: metálico, iónico, covalente.
- Propiedades físicas de las sustancias iónicas, covalentes y conductividad.
- Fuerzas intermoleculares: puente de hidrógeno y fuerzas dipolo-dipolo.
Reacciones y ecuaciones químicas
- Clasificación de reacciones químicas: síntesis, descomposición, desplazamiento simple y doble; óxido-reducción y neutralización.
- Balanceo de ecuaciones químicas.
- Estequiometría.
- Termoquímica: reacciones endotérmicas y exotérmicas.
- Equilibrio químico: constante de equilibrio y el principio de Le Chatelier (catalizador, temperatura, concentración, presión).
Guía UANL de Química resuelta
Vamos finalmente con la solución paso a paso de los 10 reactivos de química para el examen de ingreso a la UANL. Debido a que solo son 10 ejercicios, es importante que continúes practicando por tu cuenta ya que el contenido de química es extenso.
Reactivo 1: Isótopos
Considera la información que se proporciona para una serie de átomos cuyos símbolos estarán representados con la letra “X” y elige el inciso que muestre que átomos son isótopos:
- X1021
- X1122
- X1020
- X1022
- X920
- III y V
- II y IV
- I, II, y V
- I, III y IV
Solución:
Los átomos de un elemento mantienen un número fijo de protones, pero puede variar en cuanto al número de neutrones. Solamente 22 de los 119 elementos conocidos están formados por un solo tipo de átomo. La mayoría de los elementos químicos en la naturaleza están constituidos por diferentes átomos debido a que no tienen el mismo número de neutrones. Los elementos que tienen igual número de protones, pero diferente número de electrones se denominan isótopos. Algunos isótopos son naturales y otros artificiales.
Para identificar los isótopos, nos podemos apoyar en la teoría, ya que todos ellos tienen igual número de protones. Por lo tanto, entre la serie de elementos, serán isótopos todos los que tengan un valor que se repita, entre ellos:
- X1021
- X1020
- X1022
En cada inciso se observa que el número de protones siempre es 10. Incluso, podemos asociar que el elemento es el neón, ya que su número atómico es 10 y los isótopos del neón son: neón-20, neón-21 y neón-22.
La respuesta correcta es la opción D.
Reactivo 2: Electronegatividad
Del siguiente listado, coloca los sucesivos elementos en orden ascendente de acuerdo a su electronegatividad.
- Antimonio
- Oxígeno
- Bario
- Niobio
- III < IV < I < II
- II < I < III < IV
- II < I < IV < III
- III < I < II < IV
Solución:
La electronegatividad de los elementos aumenta por grupo de abajo hacia arriba y de izquierda a derecha en la tabla periódica.
Con ayuda de la siguiente tabla de electronegatividades podemos ordenar de forma sencilla el orden de los elementos según lo exige el enunciado:
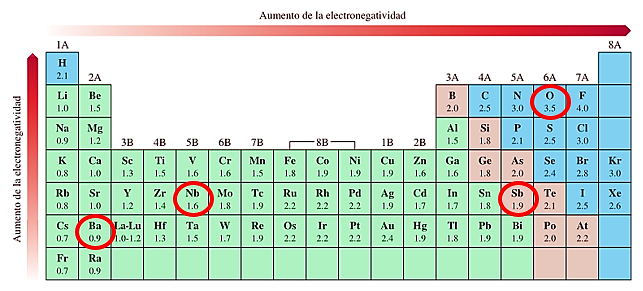
De los 4 elementos, el bario es del de menor electronegatividad, le sigue el niobio, luego el antimonio y por último, el elemento más electronegativo entre ellos, el oxígeno.
III < IV < I < II
La respuesta correcta es la opción A.
Reactivo 3: Propiedades químicas de los elementos
Del siguiente listado, elige las opciones que sean propiedades químicas
- Volumen y peso.
- Combustión y fermentación.
- Temperatura y elasticidad.
- Punto de ebullición y densidad.
Solución:
Se identifica a las sustancias por sus propiedades y composición. El color, punto de fusión y punto de ebullición son propiedades físicas. Una propiedad física se puede medir y observar sin que se modifique la composición de la sustancia. Por ejemplo, es posible medir el punto de fusión del hielo al calentar un bloque de hielo y registrar la temperatura en la que se convierte en agua.
En contraste, cuando ocurre un cambio químico que modifica la sustancia original, como por ejemplo la combustión o la fermentación, el reactivo original se transforma en productos diferentes que no conservan la composición inicial. De esta manera se dice que son propiedades químicas, ya que el cambio que ha tenido lugar hace imposible recuperar el compuesto anterior.
Por ejemplo: La fermentación es un proceso químico complejo que se utiliza en la elaboración de los vinos, en el que la glucosa se convierte en etanol y dióxido de carbono:
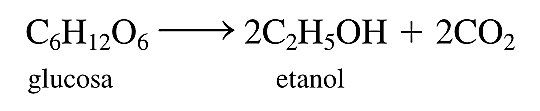
Como la reacción lo indica, la glucosa ha sido transformada a etanol y dióxido de carbono, dos compuestos completamente diferentes del cual no se puede tomar glucosa nuevamente.
La respuesta correcta es la opción B.
Reactivo 4: Modelo atómico
Selecciona el inciso que indique el número cuántico que muestra la orientación de los orbitales en el espacio.
- s
- n
- m
- l
Solución:
Los números cuánticos son parámetros asociados a magnitudes numéricas que ayudan a determinar la distribución de los electrones en un átomo.
Los números cuánticos nos ayudan a entender la forma en que se distribuyen los electrones en los orbitales atómicos. Se basan en la teoría cuántica que considera que el átomo presenta un núcleo atómico formado por protones y neutrones y los electrones se encuentran rodeándolo en niveles de energía específicos, describiendo trayectorias definidas, con una orientación determinada y los electrones girando además sobre su propio eje. Ellos son los siguientes:
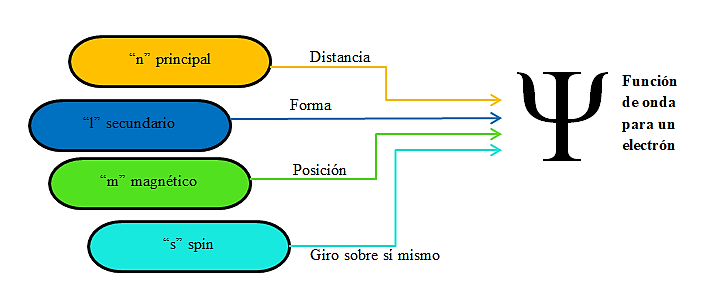
Como resume la imagen, el número cuántico “m” determina la orientación que pueden asumir los diferentes orbitales en el espacio (número de orbitales que puede contener un subnivel de energía).
En este sentido, la respuesta correcta es la opción D.
Reactivo 5: Estructura de Lewis
Identifica los enunciados que expresan las características de la estructura de Lewis.
- Es necesaria la configuración electrónica.
- No intervienen los electrones de valencia.
- Los electrones se representan con símbolos, como puntos o cruces.
- Participan en su formación los electrones internos del átomo.
- I, II
- I, III
- II, IV
- III, IV
Solución:
La capacidad de los átomos de reaccionar y enlazarse con otros está relacionada con la búsqueda de una mayor estabilidad electrónica.
En 1916, Kossel y Lewis sugirieron que los átomos que se combinan tienden a lograr una configuración electrónica parecida a la de los gases nobles. Estos gases poseen un arreglo electrónico muy particular debido a que sus átomos poseen ocho electrones en su última capa electrónica, excepto el helio que sólo posee dos. Dichos investigadores propusieron, por lo tanto, la siguiente hipótesis: Cuando los elementos forman compuestos, ganan, pierden o comparten electrones para alcanzar configuraciones electrónicas estables (de baja energía) similares a las de los gases nobles más próximos en la tabla periódica.
La estructura de Lewis comprende que los electrones de valencia que permiten la formación del enlace químico se representan a través de los llamados símbolos de Lewis. Estos se forman con el símbolo químico del elemento, alrededor del cual se colocan puntos (o equis), apareados en lo posible, en cantidades iguales a los electrones de la última capa.
Por ejemplo: El litio sólo tiene un electrón en su última capa de valencia y se representa como se observa en la imagen, según la estructura de Lewis.
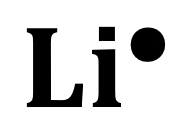
En base a la justificación teórica podemos concluir que los incisos que expresan las características de la estructura de Lewis son el I y el III. Ya que, es necesaria la configuración electrónica para que los elementos puedan alcanzar un arreglo de máxima estabilidad como el de los gases nobles. Y los electrones del elemento se representan con símbolos. La respuesta correcta es la opción B.
Reactivo 6: Enlaces químicos
Molécula que se caracteriza por tener enlace covalente no polar.
- C{H}_{4}
- CaS
- C{H}_{3}Cl
- C{H}_{3}OH
Solución:
El enlace covalente se forma entre elementos que tienen electronegatividades cercanas, de modo que ninguno atrae a los electrones con suficiente fuerza como para mantenerlo girando sobre su propio núcleo. En este caso los electrones que participan del enlace se mantienen girando alrededor de los núcleos de los átomos que comparten y así forman el enlace covalente.
El enlace covalente no polar, se forma entre átomos iguales en el que las cargas se distribuyen simétricamente o cuando la diferencia de electronegatividad de la molécula es muy baja.
Al analizar los compuestos de cada inciso, podemos determinar que las moléculas: CaS , C{H}_{3}Cl y C{H}_{3}OH poseen elementos no metálicos muy electronegativos, lo que incrementa la diferencia electronegativa del compuesto, generando un enlace polar.
A diferencia del C{H}_{4} , la electronegatividad del carbono es de 2.5 y la del hidrógeno es 2.1, la diferencia electronegativa entre ellos es de 0.4, muy baja, por lo que se considera no polar. Adicional a ello, el metano al ser una molécula simétrica anula las diferencias de electronegatividades.
En este sentido la respuesta correcta es la opción A.
Reactivo 7: Fuerzas intermoleculares
Debido a esta fuerza intermolecular, el agua es un líquido a temperatura ambiente:
- Fuerzas dipolo – dipolo.
- Puentes de hidrógeno.
- Fuerzas de Van Der Waals.
- Fuerzas de dispersión de London.
Solución:
El comportamiento particular del agua se debe a su estructura molecular. Formada por un átomo de oxígeno y dos átomos de hidrógeno. En ella, los dos pares de electrones compartidos entre ambos elementos, resultan atraídos con mayor fuerza por el átomo de oxígeno, ya que tiene una mayor electronegatividad (E = 3.5), donde se establece el polo de densidad negativa de la molécula de H2O. La zona de densidad positiva se ubica en los extremos de los átomos de H (E = 2.1) de menor electronegatividad con respecto al oxígeno.
Dicha estructura se establece mediante enlaces covalentes polares. En el mismo sentido, gracias a la polaridad que poseen las moléculas de agua se atraen entre ellas con gran facilidad, es decir, un lado positivo de la molécula se asocia con el lado negativo de otra molécula de agua formando puentes de hidrógeno.
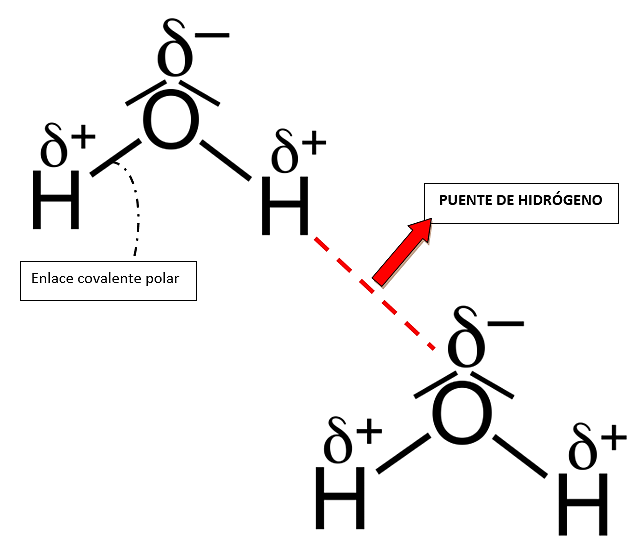
Los puentes de hidrógeno se están formando y rompiendo durante el movimiento del agua líquida como consecuencia de la energía cinética, cuando se eleva la temperatura del medio el movimiento de las moléculas es elevado, por lo tanto, la proporción con la que se rompen los puentes de hidrógeno supera a la de la formación permitiendo que el agua se libere hacia el medio en forma de gas. Los puentes de hidrógeno son las interacciones que determinan el estado de agregación del agua.
La respuesta correcta es la opción B, en base al análisis teórico.
Reactivo 8: Reacciones químicas
En este tipo de reacciones hay un intercambio de iones entre dos compuestos, generándose un precipitado o una molécula covalente estable.
- Síntesis.
- Descomposición.
- Sustitución doble.
- Sustitución simple.
Solución:
El enunciado especifica que en la reacción hay “un intercambio de iones” entre dos compuestos. Esto hace referencia a una reacción de doble sustitución.
Las reacciones de doble sustitución o doble desplazamiento, son aquellas en las que hay una transformación de la sustancia, en el estado o en la forma y, además, existe un intercambio de iones entre los compuestos. La reacción se ejemplifica de la siguiente manera:
AB+CD \to AD+CD
Es característico de las reacciones de sustitución doble la formación de un precipitado, gas o calor.
La respuesta correcta es la opción C.
Reactivo 9: Rendimiento de reacción
¿Cuántos moles de ácido carbónico, {H}_{2}C{O}_{3} , se necesitan para obtener 7.14 gramos de bicarbonato de sodio, NaHC{O}_{3} , suponiendo que la reacción se lleva a cabo al 100%?
NaOH \left(ac\right)+{H}_{2}C{O}_{3} \left(ac\right)\to NaHC{O}_{3} \left(ac\right)+{H}_{2}O \left(l\right)
- 85 moles
- 085 moles
- 0085 moles
- Ninguna de las anteriores
Solución:
Verificamos que la reacción se encuentre balanceada:

Ahora necesitamos conocer la masa molar del bicarbonato de sodio:
- Na=23 \bullet 1=23 g
- H=1 \bullet 1=1 g
- C=12 \bullet 1=12 g
- O=16 \bullet 3=48 g
masa molar de NaHC{O}_{3}=23+1+12+48=84 g
Analíticamente podemos deducir que se forman 84 g de NaHC{O}_{3} con 1 mol de {H}_{2}C{O}_{3} , ahora para formar 7.14 g de NaHC{O}_{3} ¿Cuántos moles de {H}_{2}C{O}_{3} se necesitan?
Establecemos la relación matemática:
moles de {H}_{2}C{O}_{3} para formar 7.14 g de NaHC{O}_{3}=7.14 g NaHC{O}_{3}\bullet \frac{1 mol {H}_{2}C{O}_{3}}{84 g NaHC{O}_{3}}=0.085
Se necesitan 0.085 moles de {H}_{2}C{O}_{3} para formar 7.14 g de NaHC{O}_{3} si la reacción se lleva a cabo al 100 %.
La respuesta correcta es la opción B.
Reactivo 10: Equilibrio químico
Para elaborar cloruro de hidrógeno gaseoso se puede hacer reaccionar hidrógeno gaseoso con cloro gaseoso conforme la siguiente reacción:
{H}_{2} \left(g\right)+C{l}_{2} \left(g\right)+calor \to 2HCl\left(g\right)
Si aumentamos la temperatura ¿Hacia dónde se desplaza el equilibrio o no se desplaza?
- No ocurre desplazamiento en el sistema.
- El sistema se desplaza en dirección de los reactivos.
- El sistema se desplaza en dirección de los productos.
- El sistema se desplaza primero en la dirección de los reactivos y posteriormente se desplaza en dirección de los productos.
Solución:
Una vez logrado el equilibrio de un sistema químico con condiciones determinadas, las concentraciones de las especies químicas involucradas permanecen sin cambio alguno, a menos que se produzca una perturbación desde el exterior. Entre las acciones externas que pueden alterar el equilibrio se encuentra la temperatura. Veamos de qué manera la temperatura será el cambio que favorece el desplazamiento hacia el lado derecho:
La reacción: {H}_{2} \left(g\right)+C{l}_{2} \left(g\right)+calor \to 2HCl\left(g\right) para elaborar cloruro de hidrógeno gaseoso es endotérmica debido a que se especifica en la ecuación química que para que se forme el producto necesita calor.
Por lo tanto, al aumentar la temperatura se verá favorecido el proceso consumiendo el calor que necesita la reacción endotérmica para la ruptura y formación de nuevos enlaces beneficiando el desplazamiento hacia la derecha, es decir, hacia la formación de productos.
La respuesta correcta es la opción C: El sistema se desplaza en dirección de los productos.

