Saludos, jóvenes aspirantes. ¿Quieres prepararte para la presentación del Exani II? De ser así, has llegado al lugar indicado. Acá aprenderás a desarrollar los ejercicios de química de esta prueba. Ten en cuenta que esta nueva versión del Exani II de Ceneval considera la Química como uno de los módulos de conocimiento específicos.

Acá te explicamos brevemente cómo se compone el Exani II:
- Desarrollo: Ceneval
- Examen de admisión: Exani II
- Reactivos: 168
- Tipo: Opción múltiple
- Duración: 4 horas y media
- Modalidades: Presencial, en línea y desde casa.
No olvides que, desde el verano del 2021, la nueva estructura del Exani II considera nuevos reactivos y un formato diferente. Por esto, vale la pena conocer mejor dicha estructura y cómo se dispone la información que se evalúa en esta prueba.
Ceneval, organismo responsable de diseñar, evaluar y llevar a cabo el Exani II, es un ente independiente a las universidades.
Estructura del Exani II
Lo primero que debes saber antes de empezar a solucionar los reactivos del módulo de Química, es ahondar en cuál es la estructura de preguntas del Exani II.
Por tal razón, aquí te dejamos una tabla con todas las áreas que se abordan en esta prueba:
| Área | Reactivos |
|---|---|
| Habilidades y conocimientos | |
| Pensamiento matemático | 30 |
| Comprensión lectora | 30 |
| Redacción indirecta | 30 |
| Módulos de conocimientos específicos | |
| Módulo 1 | 24 |
| Módulo 2 | 24 |
| Subtotal de reactivos | 138 |
| Diagnóstico | |
| Inglés | 30 |
| Total de reactivos | 168 |
Tabla Estructura Exani II
Como te hemos venido diciendo, este 2021 el Exani sufrió varios cambios. En estas modificaciones, los principales cambios se enfocaron en eliminar algunos módulos de conocimiento y añadir otros nuevos.
Por si te interesa, aquí puedes ver a detalle los cambios del Exani II. En este post te explicamos todos los temas del examen y cuáles son los cambios que se aplicaron a esta prueba:
Temario Química
A continuación abordaremos el temario que abarca el módulo de química de cara a presentar el examen de admisión para la universidad a la cual apliques.
Los ejercicios del área de química están incluidas en uno de los módulos de conocimiento específicos del Exani II.
Acá tienes un resumen de cuáles son los temas que abarca esta parte del examen enfocada en el estudio de la Química:
Estructura atómica
- El átomo: estructura (partículas subatómicas) y propiedades (número atómico y masa atómica)
- Tabla periódica: grupos y periodos, propiedades periódicas: electronegatividad, radio atómico, energía de ionización y estado de agregación
- Propiedades físicas y químicas de metales, no metales, semimetales y gases nobles
Enlaces químicos
- Configuración electrónica: nivel energético, orbitales atómicos, configuraciones electrónicas y electrones de valencia
- Regla del octeto y estructura de Lewis
- Tipos de enlaces químicos: metálico, iónico, covalente
- Propiedades físicas de las sustancias iónicas, covalentes y metálicas: solubilidad, punto de fusión, punto de ebullición y conductividad
- Fuerzas intermoleculares: puente de hidrógeno y fuerzas dipolo-dipolo
Reacciones y ecuaciones químicas
- Clasificación de reacciones químicas: síntesis, descomposición, desplazamiento simple y doble; óxido-reducción y neutralización
- Balanceo de ecuaciones químicas
- Estequiometría
- Termoquímica: reacciones endotérmicas y exotérmicas
- Equilibrio químico: constante de equilibrio y el principio de Le Chatelier (catalizador, temperatura, concentración, presión)
¿Qué tan difícil es el módulo de Química del Exani II?
Como en cualquier otro examen, existe una pregunta casi universal que siempre sale a acotación ante las inquietudes de aquellos que no han presentado dicha prueba. Esta es ¿Qué tan difícil es el examen? Y la respuesta a ello se basa en lo siguiente:
- ¿Has estudiado para el examen?
- ¿Cuánto tiempo le has dedicado a tu preparación?
- ¿Dominas los temas elementales que se evalúan en el examen?
Guía Exani II contestada: Química
Ahora, es momento de dar inicio a la resolución de todos los reactivos del módulo de Química del Exani II.En vista de que son muchos, dividiremos esta guía en varias partes. No olvides que lo mejor es que los resuelvas tú mismo antes de ver las respuestas.
Ten en cuenta que para el nuevo formato del Exani II, tendrás tres opciones de selección para cada reactivo. Si quieres conocer más sobre los cambios y detalles referentes al tema, mira nuestra guía completa sobre el Exani II:
Ejercicio 1: Modelo atómico
El zinc tiene una masa atómica de 65 una y un número atómico de 30 ¿Cuántos neutrones tiene?
- 30
- 35
- 65
- 95
Solución:
El núcleo atómico es la parte central del átomo donde se encuentran los protones y los neutrones. La suma de los protones y los neutrones se representa por el número de masa de un elemento y siempre es un número entero porque representa la suma de un número determinado de partículas.
La cantidad de protones de un elemento se representa mediante el número atómico (Z)
Por lo tanto, para conocer la cantidad de neutrones del zinc se debe restar el número atómico a la masa atómica.
\text { masa atómica }=N^{\circ} \text { de neutrones }+N^{\circ} \text { de protones }(Z)
N^{\circ} \text { de neutrones }=\text { masa atómica }-Z
N^{\circ} \text { de neutrones } \text { Zinc }=65-30
N^{\circ} \text { de neutrones Zinc }=35
La respuesta correcta es la opción B.
Ejercicio 2: Modelo atómico
A partir de las definiciones de los griegos y de sus propias observaciones acerca de la materia Dalton estableció en su teoría del átomo…
- Está constituido por partículas con carga positiva y negativa
- Está conformado por un núcleo con carga positiva debido a los protones
- Es la partícula más pequeña de un elemento que conserva sus propiedades
- Está conformado por un núcleo con neutrones, protones y electrones alrededor
Solución:
El filósofo griego Demócrito, en el siglo V a.C, expresó la idea de que toda la materia estaba conformada por la unión de muchas partículas pequeñas e indivisibles a las que llamó átomos (que hace alusión a indestructible o indivisible). Su opinión no fue aceptada por las mentes brillantes de la época, cómo Aristóteles y Platón, sin embargo se mantuvo a través de los años.
El científico Jhon Dalton, en el año 1808, trabajó sobre las ideas de Demócrito. Y formuló una definición precisa para las unidades con las que está formada la materia. Los trabajos de Dalton marcaron el principio de la era moderna de la química estableciendo la teoría del átomo, la cual especifica que el átomo es la partícula más pequeña de un elemento que conserva sus propiedades.
Su hipótesis también incluye que:
- Los elementos están formados por un sólo tipo de átomos
- Los átomos de un elemento tienen la misma masa, tamaño y propiedades químicas
- Cada elemento tiene átomos diferentes de otros elementos
- Durante las reacciones químicas los átomos nunca se destruyen, crean o eliminan. Sólo se combinan, reordenan o separan
La respuesta correcta es la opción C.
Ejercicio 3: Modelo atómico
El sodio tiene un número atómico de 11 y una masa atómica de 23, por lo que sus partículas subatómicas son: ___ protones, ___ neutrones y ___ electrones.
- 11, 11, 11
- 11, 12, 11
- 11, 23, 11
- 23, 12, 11
Solución:
La cantidad de protones de un elemento se representa mediante el número atómico (Z). Por lo tanto, la cantidad de protones del sodio es 11.
La masa atómica representa la suma de los protones y los neutrones. En este sentido, si la cantidad de protones del sodio es igual a 11 el número de neutrones es 12.
Como se trata de un elemento neutro, la cantidad de protones es igual a la cantidad de electrones. Entonces, la cantidad de electrones del sodio es igual a 11.
La cantidad de partículas subatómicas son:
- 11 protones
- 12 neutrones
- 11 electrones
La respuesta correcta es la opción B.
Ejercicio 4: Modelo atómico
En un átomo neutro cuya masa atómica es 31 y cuyo número atómico es 15, se tienen ___ electrones alrededor del núcleo, ___ protones y ___ neutrones dentro del núcleo.
- 15, 15, 16
- 15, 16, 15
- 16, 15, 31
- 31, 15, 16
Solución:
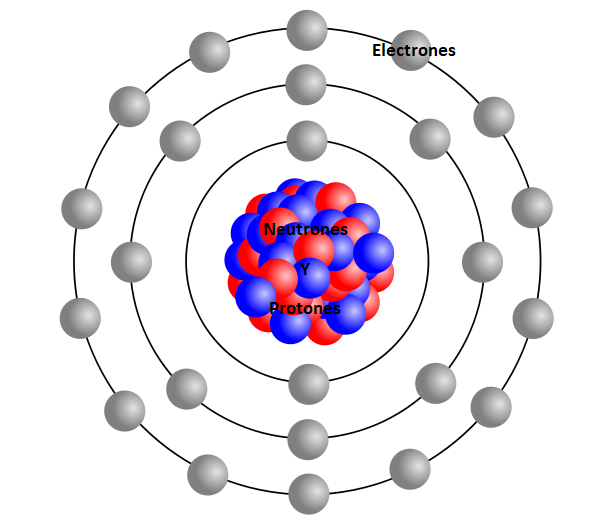
El número atómico representa la cantidad de protones del elemento y como es un átomo neutro la cantidad de protones y electrones es igual, por lo tanto el valor para ambos es 15. La masa atómica es la sumatoria del número de protones y neutrones contenidos en el núcleo. A la masa atómica se le resta la cantidad de protones para conocer el número de neutrones, el cual es igual a 16.
- 15 electrones alrededor del núcleo
- 15 protones dentro del núcleo
- 16 neutrones dentro del núcleo
La respuesta correcta es la opción A.
Ejercicio 5: Modelo atómico
Si el elemento químico oro (Au) posee una masa atómica de 197 y un número atómico de 79 ¿Cuántos neutrones contiene en su núcleo?
- 79
- 118
- 197
- 276
Solución:
La cantidad de neutrones presentes en el núcleo del átomo se conoce al restar el número atómico a la masa atómica.
\begin{array}{c} N^{\circ} \text { de neutrones }=\text { masa atómica }-Z \\ N^{\circ} \text { de neutrones }=197-79 \\ N^{\circ} \text { de neutrones }=118 \end{array}
La respuesta correcta es la opción B.
Ejercicio 6: Modelo atómico
Con base en el número de masa/número atómico ¿Cuál de los siguientes átomos tiene el mayor número de neutrones en su núcleo?
- Ne 20/10
- Na 23/11
- Mg 24/12
- Si 28/14
Solución:
Para conocer el átomo con mayor cantidad de neutrones en el núcleo, se debe restar el número atómico al valor de la masa atómica de cada elemento:
- Ne 20 – 10= 10 neutrones
- Na 23 – 11= 12 neutrones
- Mg 24 – 12= 12 neutrones
- Si 28 – 14= 14 neutrones
Los átomos del Si son los que tienen una mayor cantidad de neutrones en el núcleo en comparación con los demás elementos. La opción correcta es la D.
Ejercicio 7: Distribución electrónica de los elementos
A partir de su configuración electrónica 1 s^{2} 2 s^{2} 2 p^{6} 3 s^{2} , este elemento se encuentra en el periodo ___ y tiene 2 electrones de valencia.
- 1
- 2
- 3
- 6
Solución:
La estructura atómica de un elemento en particular, dependerá del número de niveles y subniveles energéticos que presente; este depende, a su vez, del número de electrones que contenga. La ubicación de un elemento en la tabla periódica se puede conocer por la parte final de su configuración electrónica, es decir, para el elemento del enunciado la configuración electrónica es:
1 s^{2} 2 s^{2} 2 p^{6} 3 s^{2}
Si queremos saber el período en el que se encuentra dentro de la tabla periódica, tomamos en consideración la parte final de su configuración:
3 s^{2}
Dónde:
- 3 representa el nivel energético (período)
- s es el subnivel energético
- 2 es la cantidad de electrones de ese subnivel
La respuesta correcta es la opción C.
Ejercicio 8: Tabla periódica
De acuerdo con su ubicación en la tabla periódica ¿Qué elemento tiene mayor carácter metálico?
- Silicio
- Azufre
- Aluminio
- Magnesio
Solución:
Para conocer la tendencia metálica de los elementos dentro de la tabla periódica se debe tener presente que:
- La cualidad metálica incrementa a medida que se desciende por un grupo (columna)
- La cualidad metálica disminuye si se avanza de izquierda a derecha por los períodos
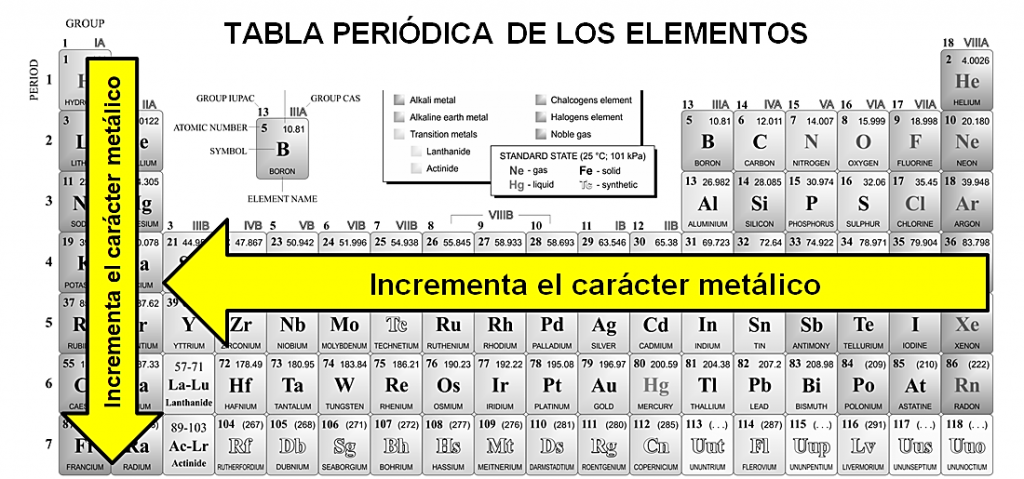
En este sentido, el Mg es el elemento que se encuentra más hacia la izquierda, por lo tanto, es el de mayor carácter metálico entre las opciones.
La respuesta correcta es la opción D.
Ejercicio 9: Tabla periódica
De acuerdo con su ubicación en la tabla periódica ¿Cuál elemento posee mayor radio atómico?
- Fósforo (P)
- Azufre (S)
- Cloro (Cl)
- Sodio (Na)
Solución:
El radio atómico es una propiedad que se define como la mitad de la distancia promedio entre dos núcleos que interactúan. Dentro de la tabla periódica el radio atómico incrementa a medida que se descienden por los grupos y disminuye cuando se avanza de izquierda a derecha.
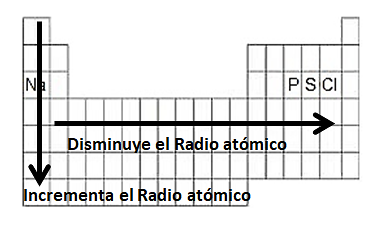
El sodio es el elemento que se encuentra más hacia la izquierda, por lo tanto posee un radio atómico mayor que el P, S y Cl.
El radio atómico está asociado con el potencial de ionización de un elemento, el cual es la energía necesaria para arrancar un electrón de un elemento químico, encontrándose en su estado fundamental de energía.
Cuando un electrón se encuentra más cerca del núcleo, el potencial de ionización es mayor. En este sentido, cuando un átomo posee un mayor radio atómico, menor es el potencial de ionización de ese elemento y le será mucho más fácil ceder sus electrones durante las reacciones químicas.
La respuesta correcta es la opción D.
Ejercicio 10: Tabla periódica
¿A qué corresponden los períodos en la tabla periódica de los elementos?
- Electrones de valencia
- Número de niveles de energía del átomo
- Número total de electrones del átomo
- Cantidad de nucleones
Solución:
Las líneas horizontales de la tabla periódica son los períodos. Representan el número cuántico principal más elevado que presente la distribución electrónica. Es decir, el período representa los niveles de energía principales del átomo. En este sentido, la respuesta correcta es la opción B.
La tabla periódica es de gran utilidad, ya que mediante la clasificación de los elementos dentro de un grupo o período se tiene conocimiento de las propiedades, comportamiento y tendencias de un elemento, así este sea poco conocido.
Estas son algunas reglas para ubicar elementos dentro de la tabla periódica:
- Si en la penúltima capa de energía hay 2 u 8 electrones, el elemento será parte del grupo A, y el grupo será numéricamente igual a la cantidad de electrones que se encuentran en la última capa
- Si existen 18 electrones en la penúltima capa de energía y 1 o 2 en la última, el elemento pertenece a la clase B y el grupo será 1 o 2 de acuerdo a la cantidad de electrones presentes en la última capa
- En el caso de tener 18 electrones en la penúltima capa de energía y más de dos electrones en la última, el elemento será de la serie A y el grupo se asignará de acuerdo a la cantidad de electrones presentes en la última capa
- Si en la penúltima capa de energía tiene más de 8 pero menos de 18 electrones, el elemento pertenece a la serie B y el grupo será igual al número de electrones contenidos en el último orbital “d” y “s”, al grupo 8 serán correspondientes los elementos que contengan 8, 9 o 10 electrones
- En el caso de contener el orbital f lleno o semi-lleno, el elemento pertenece a la serie B, al grupo de elementos de transición interna

