¡Hola aspirante! Es un gusto verte de nuevo, ahora ha llegado el turno de resolver los reactivos del 11 al 20, correspondientes a la segunda parte de los ejercicios de química del simulacro para el examen de ingreso EXANI II.

Recuerda responder por tu cuenta antes de mirar la solución. Este simulacro tiene la finalidad de acercarte a los ejercicios que saldrán en la prueba real, la única forma de obtener una calificación excelente es a través de la práctica constante.
Ejercicios de Química
Seguimos con la solución de los reactivo simulacro de química para EXANI. En esta segunda parte una vez que hayas elegido la opción correcta, analiza nuevamente el enunciado, identifica las posibles fallas y supera tu tiempo de respuesta.
Reactivo 11
Para que las ecuaciones químicas representen fielmente un proceso químico debe existir equilibrio entre los elementos reaccionantes y los productos. Esta condición se denomina:
- Balanceo
- Estequiometría
- Molaridad
Solución:
El balanceo de una ecuación química es sinónimo de equilibrio. El objetivo del balanceo es igualar el número de átomos antes y después de la reacción para que se cumpla la ley de conservación de la masa.
Además, para que una reacción química represente fielmente un proceso químico, la ecuación debe estar balanceada pero también las fórmulas químicas tienen que escribirse correctamente en ambos lados de la reacción.
La respuesta correcta es la opción A.
Añadido:
Reactivo 12
¿Cuántos gramos de ácido bromhídrico serán necesarios para precipitar todo el litio contenido en una muestra de 4 g de hidróxido de litio?
HBr+ LiOH \to LiBr+{H}_{2}OConsidere:
HBr = 81 g/mol
LiOH = 24 g/mol
LiBr = 87 g/mol
- 12.3
- 13
- 13.5
Solución:
Primero debemos verificar que la ecuación se encuentra balanceada
HBr+ LiOH \to LiBr+{H}_{2}O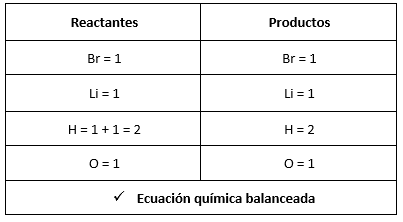
Luego, determinamos las relaciones de aquellos compuestos que nos interesan:
- 1 mol de LiOH reacciona con 1 mol de HBr
- 24 g de LiOH reaccionan con 81 g de HBr
Ahora resolvemos mediante una regla de tres
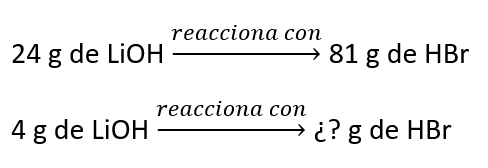
Es decir:
4 g LiOH \bullet \frac{81 g HBr}{24 g LiOH}=13.5 g HBrSe necesitan 13.5 g de HBr para precipitar todo el Li contenido en presente en una muestra de LiOH.
Respuesta correcta opción C.
Reactivo 13
Nombre el proceso químico en el que una o varias sustancias se transforman en otras con propiedades y características diferentes
- Estequiometría
- Reacción química
- Entalpía de reacción
Solución:
En la naturaleza se hallan sustancias químicas en diferentes estados de la materia, estas pueden ser elementales o compuestas, tienen aplicaciones muy diversas y pueden sufrir cambios cuando se someten a condiciones específicas; el proceso mediante el cual una o varias sustancias se transforman en otras con propiedades y características diferentes se conoce como reacción química.
Respuesta correcta opción B.
Reactivo 14
Los procesos exotérmicos se caracterizan por:
- Consumir energía
- Liberar energía
- Mantener energía
Solución:
Durante las reacciones químicas ocurren cambios relacionados con la liberación y consumo de energía. Cuando hablamos de un proceso exotérmico, significa que la reacción genera el incremento de temperatura del medio en el que se encuentra, ya que libera energía. Las reacciones de combustión son un ejemplo de ellas.
Respuesta correcta opción B.
Reactivo 15
En el compuesto M{g}_{3}{\left(P{O}_{4}\right)}_{2} ¿Cuántos átomos de oxígeno hay?
- 12
- 4
- 2
Solución:
Los átomos de oxígeno presentes en el compuesto son el resultado de la multiplicación del subíndice 4 por el 2, es decir 12 átomos de oxígeno.
La respuesta correcta es la opción A.
Reactivo 16
¿Cuál es la fórmula utilizada para conocer ∆{H}_{reacción} ?
- ∆{H}_{reacción}= \sum ∆{H}_{formación}\left(productos\right)+ \sum ∆{H}_{formación}\left(reactantes\right)
- ∆{H}_{reacción}= \sum ∆{H}_{formación}\left(reactantes\right)- \sum ∆{H}_{formación}\left(productos\right)
- ∆{H}_{reacción}= \sum ∆{H}_{formación}\left(productos\right)- \sum ∆{H}_{formación}\left(reactantes\right)
Solución:
Cuando se tienen las entalpías de formación de todas las sustancias que intervienen en un proceso químico se puede calcular la variación de la entalpía (∆H) de reacción restando la sumatoria de la entalpía de los reactantes de la sumatoria de la entalpía de los productos; tal cual como lo expresa la ecuación:
∆{H}_{reacción}= \sum ∆{H}_{formación}\left(productos\right)- \sum ∆{H}_{formación}\left(reactantes\right)Respuesta correcta opción C.
Reactivo 17
¿Cuál de los siguientes compuestos es un ácido fuerte?
- C{H}_{3}COOH
- HCl
- HN{O}_{2}
Solución:
Los ácidos y las bases fuertes son aquellos compuestos que cuando se colocan en una disolución acuosa se disocian en su totalidad.
En el problema, podemos identificar que el único ácido fuerte presente es el HCl, en disolución acuosa sus moléculas se pasan a forma iónica:
HCl \to {H}^{+}+C{l}^{-}Importante, para los ácidos fuertes (como el HCl) o las bases fuertes (como el NaOH) la flecha de la ecuación química es de un solo sentido hacia la formación de los productos ya que la disociación del compuesto es total.
Respuesta correcta opción B.
Reactivo 18
¿Cuál es el tipo de hibridación que presentan los enlaces de carbono en la siguiente estructura?
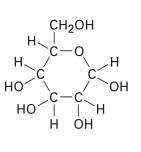
- sp
- s{p}^{2}
- s{p}^{3}
Solución:
Aunque parece una molécula compleja, la respuesta es muy sencilla, todos los enlaces presentes en el compuesto son sencillos, por lo tanto, la hibridación es s{p}^{3}.
Respuesta correcta opción C.
Reactivo 19
Es una propiedad física de los compuestos orgánicos:
- Puntos de fusión y de ebullición inferiores a 300 °C
- No volátiles
- Puntos de fusión y de ebullición superiores a 700 °C
Solución:
En la actualidad se conocen millones de compuestos orgánicos los cuales contienen además de carbono e hidrógeno, oxígeno, nitrógeno, azufre, fósforo y halógenos. Es importante diferenciarlos de los compuestos inorgánicos y para ello podemos apoyarnos en las propiedades físicas y químicas de cada uno.
Una de las propiedades físicas de los compuestos orgánicos es que poseen puntos de fusión y ebullición inferiores a los 300 °C, mientras que los compuestos inorgánicos cuentan con puntos de fusión y ebullición superiores a los 700 °C, por lo general.
La respuesta correcta es la opción A.
Reactivo 20
Nombre del compuesto contenido en el gas natural que se emplea para la obtención de amoníaco, además, es utilizado como refrigerante y como materia prima de la urea.
- Eteno
- Crisol
- Metano
Solución:
El metano ( \mathit{C}{\mathit{H}}_{4} ) pertenece al grupo funcional de los alcanos, los cuales son compuestos orgánicos de cadenas carbonadas simples.
El metano se utiliza como refrigerante, se encuentra en el gas natural, es utilizado como materia prima para generar urea para el abono nitrogenado de los suelos en la agricultura y también se aplica como combustible en los hornos industriales y domésticos.
Respuesta correcta opción C.

