¡Hola aspirante! Es el turno de estudiar el módulo de química, en este tutorial vamos a resolver los primeros 10 ejercicios del simulacro de química del nuevo examen de ingreso diseñado por Ceneval Exani II.

Aunque todos los reactivos del simulacro poseen las justificaciones explicadas paso a paso, te recomiendo que respondas por tu cuenta antes de mirar la solución; de esta manera aceleras el proceso de aprendizaje.
Estructura del Exani II
La prueba de ingreso, elaborada por Ceneval, consta de dos grandes partes: la primera, que trata sobre conocimientos generales, también denominada habilidades y conocimientos, y la segunda, acerca de conocimientos específicos.
Los conocimientos generales tienen 30 reactivos de química (similares a los de este simulacro) y unos 60 de español divididos equitativamente entre comprensión lectora y redacción indirecta.
También existe un examen diagnóstico de inglés, cuya aplicación depende de la universidad y el resultado no afectará tu puntuación final.
En la siguiente tabla contiene un resumen exacto de la estructura de la prueba diseñada por Ceneval.
Conoce la estructura de la guía Exani II y del examen de ingreso
| Área | Reactivos |
|---|---|
| Habilidades y conocimientos | |
| Pensamiento matemático | 30 |
| Comprensión lectora | 30 |
| Redacción indirecta | 30 |
| Módulos de conocimientos específicos | |
| Módulo 1 | 24 |
| Módulo 2 | 24 |
| Subtotal de reactivos | 138 |
| Diagnóstico | |
| Inglés | 30 |
| Total de reactivos | 168 |
Temario Química
A continuación abordaremos el temario que abarca el módulo de química para que ampliar tú conocimiento en cuanto a la prueba.
Los ejercicios del área de química están incluidas en uno de los módulos de conocimiento específicos del Exani II.
Acá tienes un resumen de cuáles son los temas que abarca esta parte del examen enfocada en el estudio de la Química:
Estructura atómica
- El átomo: estructura (partículas subatómicas) y propiedades (número atómico y masa atómica)
- Tabla periódica: grupos y periodos, propiedades periódicas: electronegatividad, radio atómico, energía de ionización y estado de agregación
- Propiedades físicas y químicas de metales, no metales, semimetales y gases nobles
Enlaces químicos
- Configuración electrónica: nivel energético, orbitales atómicos, configuraciones electrónicas y electrones de valencia
- Regla del octeto y estructura de Lewis
- Tipos de enlaces químicos: metálico, iónico, covalente
- Propiedades físicas de las sustancias iónicas, covalentes y metálicas: solubilidad, punto de fusión, punto de ebullición y conductividad
- Fuerzas intermoleculares: puente de hidrógeno y fuerzas dipolo-dipolo
Reacciones y ecuaciones químicas
- Clasificación de reacciones químicas: síntesis, descomposición, desplazamiento simple y doble; óxido-reducción y neutralización
- Balanceo de ecuaciones químicas
- Estequiometría
- Termoquímica: reacciones endotérmicas y exotérmicas
- Equilibrio químico: constante de equilibrio y el principio de Le Chatelier (catalizador, temperatura, concentración, presión)
¿Cómo resolver el examen simulacro?
Los ejercicios del simulacro que hemos elaborado para ti, tienen como finalidad ayudarte a:
- Practicar los temas precisos que van para el examen.
- Acortar el tiempo que tardas en resolver cada reactivo.
En tu calendario de estudio debes incluir los exámenes simulacro, de esta manera estimulas la agilidad para recordar la teoría y responder en poco tiempo.
Ten en cuenta las siguientes consideraciones durante el examen simulacro, el cual es una modalidad réplica de la prueba real:
- Resuelve completa cada parte por tu cuenta antes de mirar las respuestas
- Establece un tiempo no mayor a 20 minutos por cada 10 reactivos
- Analiza el procedimiento que has seguido para resolver los ejercicios y piensa en posibles alternativas que acorten el tiempo
- Asegúrate de tener unos minutos de sobra para comprobar tus respuestas
- Si un ejercicio parece complejo, ve al siguiente y resuélvelo de último. Lo mejor es mantener la concentración y no entrar en pánico.
Ejercicios de Química
¡Ahora sí! Es el momento de poner a prueba tus conocimientos en el área de la química, la ciencia que se encarga del estudio de la materia y su interacción con diferentes sistemas.
Demos inicio a los primeros 10 reactivos, tipo selección múltiple, del examen simulacro de químicaa basado en el examen real de Ceneval Exani.
Reactivo 1
El criterio utilizado para definir un enlace iónico en la unión de dos elementos el valor de la diferencia de electronegatividades entre ellos debe ser superior a:
- 2.7
- 1.7
- 0.7
Solución:
En la formación de un enlace iónico entre dos elementos ocurre un intercambio de electrones, es decir que uno de ellos cede los electrones y el otro los recibe. En la unión, uno de los participantes se convierte en anión y el otro en catión.
El criterio utilizado para definir un enlace como iónico es que la diferencia de electronegatividades de los elementos involucrados sea mayor a 1.7; para calcular la diferencia se utiliza la tabla de electronegatividades, en donde se observa que el flúor es el elemento más electronegativo de la tabla periódica.
Respuesta correcta opción B.
Reactivo 2
¿Qué tipo de hibridación posee el siguiente compuesto?
C{H}_{3}-C{H}_{2}-C{H}_{2}-C{H}_{2}-C{H}_{2}-C{H}_{3}- sp
- s{p}^{2}
- s{p}^{3}
Solución:
El compuesto que nos muestra el enunciado es un alcano y la principal característica de las moléculas hidrocarbonadas alcanos es que sólo presentan enlaces covalentes sencillos, es decir, una hibridación s{p}^{3} .
Los alcanos se conocen como hidrocarburos saturados porque contienen el número máximo de átomos de hidrógeno que pueden unirse con la cantidad de átomos de carbono presentes.
La respuesta correcta es la opción C.
Reactivo 3
Indique los coeficientes correspondientes dada la reacción química:
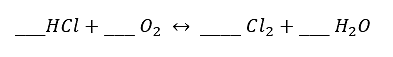
- 1, 2, 3, 4
- 4, 1, 2, 2
- 4, 1, 1, 2
Solución:
Para conocer los coeficientes de cada compuesto se debe verificar la cantidad de elementos que hay en ambos lados de la reacción.
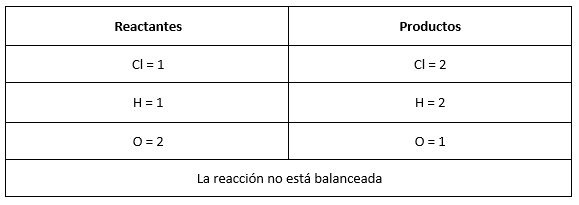
Para balancear identificamos un número que multiplicado por la cantidad de átomos presentes (subíndice) iguale la cantidad de elementos a ambos lados de la reacción, en este caso sería:
![]()
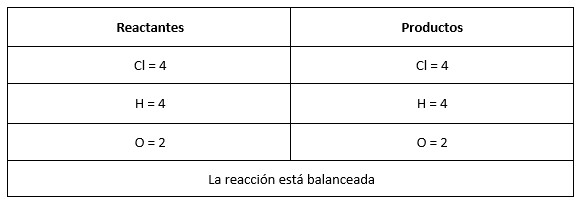
Respuesta correcta opción B.
Reactivo 4
Cuando se posee una solución altamente diluida conviene expresar la concentración en:
- % m/v
- %m/m
- ppm
Solución:
Cuando las disoluciones están muy diluidas expresar la concentración en porcentaje complica los cálculos, ya que posee muchos ceros porque el valor es sumamente pequeño, para estos casos es preferible utilizar la concentración en partes por millón (ppm), lo que significa que hay una parte de soluto disuelto por cada millón de partes de disolución.
Respuesta correcta opción C.
Reactivo 5
Si la diferencia de electronegatividad entre el H y el F es de 1.9 estamos en presencia de un enlace:
- Iónico
- Covalente
- Coordinado
Solución:
El criterio utilizado para definir un enlace como iónico es que la diferencia de electronegatividades de los elementos involucrados sea mayor a 1.7; como lo mencionamos en el ejercicio 1, por ello para el presente enunciado la respuesta correcta es la opción A.
Reactivo 6
Cuando se habla de una disolución sobresaturada se expresa que:
- La disolución tiene la mínima cantidad de soluto disuelto a presión y temperatura constante
- La disolución tiene un exceso de solvente a presión y temperatura determinada
- La disolución tiene un exceso de soluto disuelto a una determinada presión y temperatura
Solución:
Las disoluciones sobresaturadas se caracterizan por que poseen un exceso de soluto disuelto en ellas a una presión y temperatura determinada.
La respuesta correcta es la opción C.
Reactivo 7
La ___________________ es el desplazamiento de los electrones del enlace hacia uno de los átomos que lo forman, produciéndose una zona positiva por deficiencia de electrones y otra negativa por el exceso de los mismos.
- Polaridad de enlace
- Entalpía
- Entalpía de reacción
Solución:
La polaridad de enlace es el desplazamiento de los electrones del enlace hacia uno de los átomos que lo forman, produciéndose una zona positiva por deficiencia de electrones y otra negativa por el exceso de los mismos.
La máxima expresión de polaridad la podemos encontrar en los enlaces iónicos.
Respuesta correcta opción A.
Reactivo 8
Las reacciones de doble descomposición se caracterizan por presentar la ruptura y reordenamiento de los componentes que participan en la reacción química. Un ejemplo de este tipo son las reacciones:
- Entre el oxígeno y los metales
- Entre el hidrógeno y un no metal
- Entre un ácido y una base
Solución:
Las reacciones de doble descomposición se caracterizan por presentar la ruptura y reordenamiento de los componentes que participan en la reacción química. Un ejemplo de este tipo son las reacciones de neutralización que se producen por la interacción de un ácido y una base formando sal y agua.
El cambio químico de doble descomposición también puede ocurrir en las reacciones de óxidos básicos y ácidos o entre dos sales.
Respuesta correcta opción C.
Reactivo 9
La descomposición térmica del clorato de potasio genera cloruro de sodio y oxígeno molecular ¿Cuál de las siguientes ecuaciones químicas representa la reacción?
- KC{l}_{2}O\to KC{l}_{2}+\frac{3}{2} O\uparrow
- KCl{O}_{3} \stackrel{∆}{\to } KCl+\frac{3}{2} {O}_{2} \uparrow
- KCl{O}_{3} \stackrel{∆}{\to } KCl+\frac{3}{2} {O}_{2} \downarrow
Solución:
Para resolver este tipo de ejercicios es imprescindible familiarizarnos con la simbología química, ya que será de gran ayuda para reacciones mal escritas.
Por ejemplo, para hallar la respuesta correcta podemos analizar cada una de las reacciones y descartar las incorrectas:
Dada la reacción de la opción a)
KC{l}_{2}O\to KC{l}_{2}+\frac{3}{2} O\uparrow
Identificamos diversos errores:
- El primero es que clorato de potasio está mal escrito, la formulación correcta es KCl{O}_{3}
- El segundo es que cloruro de potasio está mal escrito, la fórmula correcta es KCl
- Tercero, la ecuación no posee el símbolo delta ( ∆ ) el cual significa presencia de calor
- Por último, el oxígeno molecular se escribe así: {O}_{2}
Dada las incoherencias que presenta la ecuación química, podemos descartar la reacción a.
Las reacciones químicas de las opciones b) y c) son sumamente similares, sin embargo, la simbología química nos ayuda, ya que en la reacción c), la flecha hacia abajo que se encuentra junto al {O}_{2} indica precipitación y el oxígeno molecular es gaseoso, se libera en forma de gas, por lo tanto, la única opción correcta es la b).
KCl{O}_{3} \stackrel{∆}{\to } KCl+\frac{3}{2} {O}_{2} \uparrow
- Ecuación correctamente balanceada
- Formulación de compuestos correcta
- Simbología química adecuada
Respuesta correcta opción B.
Reactivo 10
¿Cuál es la propiedad que permite relacionar la masa y el volumen en las tres formas de expresión porcentual para la concentración de las disoluciones?
- Densidad
- Temperatura
- Número de moles
Solución:
En ciertas ocasiones se hace necesario relacionar la masa y el volumen de una concentración en términos cuantitativos, por lo que se utiliza la densidad para relacionar las tres formas de expresión porcentual.
Respuesta correcta opción A.

