Aprende las propiedades físicas y químicas de la materia para saber qué es un material en base a sus características específicas y medibles.

La comprensión de la materia continúa con el estudio de sus propiedades. Al finalizar el post habrás dominado un área más de la química.
¿Qué es una propiedad de la materia?
Son las características que nos permiten distinguir, clasificar y determinar el uso de la materia. Todas las sustancias poseen cualidades que permiten describirlas y compararlas con otras para diferenciarlas.
¿Cuáles son las propiedades de la materia?
Todas las sustancias poseen propiedades, algunas físicas y otras químicas, cada una tiene cualidades específicas para describir la materia.
Propiedades físicas de la materia
- Términos como la masa, el volumen y la temperatura nos permiten diferenciar tipos de materia y su información es útil para manipular los materiales en general.
- Cuando deseamos identificar un material recurrimos a estudiar sus cualidades específicas que lo hacen único.
Por ejemplo, la sal y el azúcar se diferencian por su sabor, los perfumes se distinguen por el olor o una tela se elige en lugar de otra en base a su textura.
En este sentido, el color, el olor y la textura de los materiales pueden ayudar a diferenciarlos entre sí, en algunos casos. Sin embargo, no siempre estas propiedades son suficientes para identificar todos los materiales, aunque sean características de ellos.

Existen varias propiedades físicas cuantificables muy usadas para identificar los materiales. Estas propiedades son características y no se alteran ya que son inherentes a su propia naturaleza. Entre se encuentran el punto de fusión, el punto de ebullición, la densidad y la solubilidad.
Por ello, en la química se llega a la conclusión de que todas las propiedades medibles o físicas de la materia corresponden a una de dos categorías especiales: propiedades extensivas y propiedades intensivas.
Propiedades extensivas de la materia
Entre ellas podemos mencionar:
Es la cantidad de materia que posee un cuerpo determinado. Se mide con el uso de una balanza. La masa de una sustancia es independiente de la de la gravedad y no varía con los cambios de altitud o presión.
La masa normalmente se confunde con el peso, pero ambos son conceptos diferentes.
Es la fuerza con la que la tierra atrae un cuerpo, depende de la aceleración de gravedad y varía según la ubicación de la materia en cualquier punto de la tierra. Su medición se hace a través de un dinamómetro.
Se refiere al espacio ocupado por la materia en cualquier estado físico (sólido, líquido o gaseoso).
Es la medida del grado de calor contenido en un cuerpo. Se utiliza un termómetro para determinar su valor en grados.
La temperatura no mide el calor de un cuerpo, sino el “grado” de calor. Es importante tener esto en mente, porque se tienden a confundir las definiciones de calor y temperatura. El calor es una forma de energía y su medición se hace en calorías.
Es el nivel de espacio entre las partículas de la materia que permite la absorción de gases o líquidos.
Propiedades intensivas o específicas de la materia
Esto quiere decir, que 1Kg de oro y 1 g de oro siempre tendrá la misma densidad, ya que es una propiedad característica de dicha sustancia y conocer su valor permite distinguir el material de otros.
Entre ellas podemos mencionar:
El valor de la densidad es único para cada tipo de materia a presión y temperatura constante, por lo que se utiliza para identificar las sustancias.
Mientras mayor es la cantidad de materia presente en una unidad de volumen, el valor de la densidad será mayor. Por ejemplo, la mayoría de los metales tienen densidades altas.
Cuando un sólido es calentado su temperatura aumenta progresivamente hasta que comienza a “fundirse” y cambia del estado sólido al estado líquido.
Esto sucede porque el incremento de la temperatura desestabiliza la estructura del sólido, y las moléculas que lo conforman pasan a un estado menos rígido y con mayor proporción de desorden.
- El valor de la temperatura que alcanza el punto de fusión es único para cada sustancia.
- El punto de fusión depende de la presión atmosférica, para medir la temperatura de fusión se estableció como referencia 1 atmósfera, qué es la presión atmosférica al nivel del mar.

Cuando un líquido es calentado su temperatura incrementa de forma progresiva hasta que se genera un burbujeo evidente en la sustancia. En ese momento se alcanza la temperatura de ebullición y el líquido se transforma en gas.
Durante la fase de cambio la temperatura de la sustancia permanece constante, aun cuando se mantenga al fuego.La presión atmosférica también influye en el punto de ebullición de una sustancia, por ello, si se hace a una atm diferente de 1 se debe reportar.
La solubilidad también es una propiedad específica de cada sustancia, en el caso de los gases la presión es un factor que no se debe dejar de lado.
La solubilidad se relaciona con el tema de las soluciones, para comprender en un amplio sentido su concepto definiremos:
- Soluto: Es la sustancia que es capaz de disolverse en otra.
- Disolvente: Es la sustancia que tiene la capacidad de disolver al soluto.
Existe una regla común que dice “Semejante disuelve a semejante” esto quiere decir que mientras mayor sea la compatibilidad molecular del soluto con el disolvente, mayor será su solubilidad.
Propiedades químicas de la materia
Recordar las propiedades químicas de la materia es muy sencillo, porque cuando sucede el “cambio químico” la sustancia no vuelve a ser la misma que originalmente era.
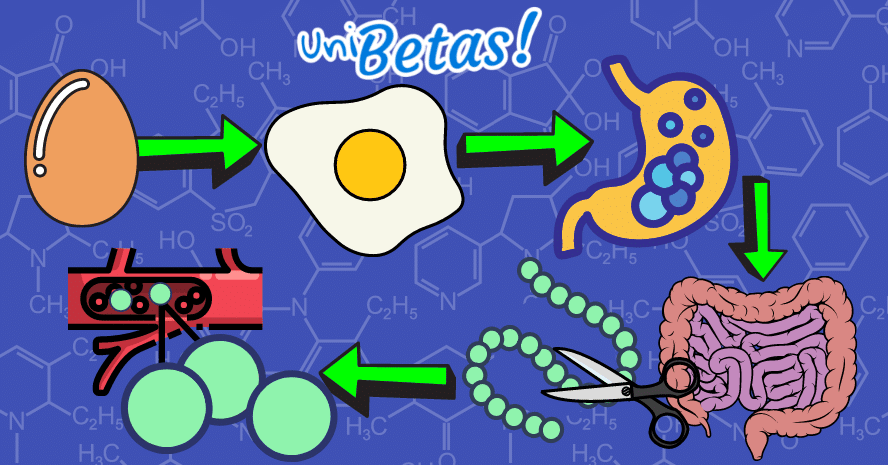
Por ejemplo, al cocer un huevo a la plancha se somete a una temperatura de 100°C aproximadamente que transforma la clara y la yema del huevo. El huevo cocido adquiere consistencia sólida y cambia de color.
Químicamente las proteínas contenidas en el huevo se desnaturalizan y cambian su forma original.
Cuando el huevo cocido se ingiere es transformado a lo largo del tubo digestivo por el HCl secretado a nivel estomacal y las enzimas pancreáticas e intestinales que lo degradan a sus unidades constituyentes, los aminoácidos. Los cuales son absorbidos en las vellosidades del intestino delgado y pasan a la sangre para cumplir diferentes funciones en el organismo.
Todo el proceso representa un cambio químico de la materia.
Las propiedades químicas pueden ser:
Poder oxidante
Se define como la fuerza de una sustancia para provocar la oxidación de otra sustancia que participa en la reacción a través de la ganancia de electrones.
Poder reductor
Se define como la fuerza de una sustancia para promover la reducción de otra sustancia que participa en la reacción química a través de la donación de electrones.
Combustión
Son aquellas reacciones químicas que liberan energía en forma de calor (exotérmicas) y ocurren entre un agente oxidante, como el oxígeno, y una sustancia capaz de oxidarse de forma rápida (combustible).
A lo largo del texto hemos mencionado que muchas de las propiedades de la materia dependen de la presión atmosférica, pero a qué se refiere dicho término exactamente. Lo puedes averiguar a continuación:
¿Qué es la presión atmosférica?
Se refiere a la presión que ejercen las capas de aire de la atmósfera sobre la superficie de la tierra.Por regla general, la presión atmosférica de referencia es la que se encuentra a nivel del mar (1 atm condiciones normales). Esta decrece en zonas elevadas, es decir que en áreas montañosas la presión atmosférica es inferior.
Para medir las propiedades intensivas de la materia la presión atmosférica siempre debe ser tomada en cuenta.

