Si vas a presentar el examen a la licenciatura en ciencias genómicas de la modalidad de ingreso indirecto, en este artículo vamos a resolver la guía del examen de admisión interno en el módulo de química.

Recuerda que para ingresar a esta licenciatura es necesario que primero apliques a la convocatoria vigente, y resultes seleccionado en alguna de las carreras de origen, puedes aplicar a cualquier carrera del área I o II.
Requisitos de ingreso:
- Completar la solicitud de registro en el portal e instancias oficiales.
- Presentar un examen de conocimientos y obtener un resultado satisfactorio, las áreas que se evalúan son matemáticas, química y biología.
- Entrevista personal con comité evaluador.
La licenciatura se oferta en el centro de ciencias genómicas y en la Escuela Nacional de Estudios Superiores Juriquilla.
Consulta los otros temas del examen:
- Guía UNAM LCG | Módulo de Matemáticas de ciencias genómicas
- Guía UNAM LCG | Módulo de Biología de Ciencias Genómicas
Química General
Reactivo 1
Indique el orden de llenado de los orbitales en los subniveles energéticos del Kriptón:
- 1{s}^{2}, 1{p}^{6}, 2{s}^{2}, 3{s}^{2}, 3{p}^{6}3{d}^{10}
- 1{s}^{2}, 2{s}^{2}, 2{p}^{6}, 3{s}^{2}, 3{p}^{6}, 3{d}^{10}, 4{s}^{2}, 4{p}^{6}
- 1{s}^{2}, 2{s}^{2}, 2{p}^{6}, 3{s}^{2}, 3{p}^{6}, 4{s}^{2}, 3{d}^{10}, 4{p}^{6}
- 1{s}^{2}, 2{s}^{2}, 3{s}^{2}, 4{s}^{2}, 2{p}^{6}, 3{p}^{6}, 4{p}^{6}, 3{d}^{10}
- Ninguno de los anteriores
Solución:
El Kriptón es un gas noble. Pertenece al grupo VIII-A de la tabla periódica.
Para establecer la configuración electrónica del Kr, lo primero que debemos conocer es su número atómico, es decir, la cantidad de protones presentes en el núcleo del átomo (Z).
- Kr: Z=36
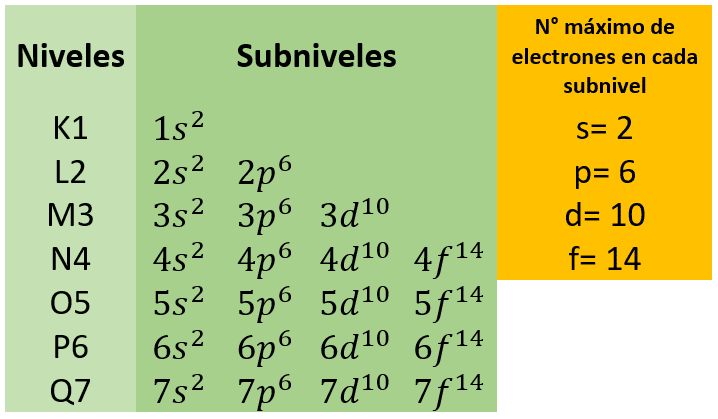
Un átomo tiene diversas capas de electrones girando alrededor del núcleo. Las capas más externas son las que le permiten formar enlace con otros átomos. Y la estructura atómica de un elemento dependerá del número de niveles y subniveles de energía que presente.
Los niveles de energía están formados por las capas de electrones representadas por las letras: K1 (la más cercana al núcleo del átomo), L2, M3, N4, O5, P6, y Q7
Estos niveles poseen subniveles s, p, d, f… compuestos por orbitales atómicos, los cuales definen la distribución de la densidad electrónica, estableciendo un número específico de electrones en cada subnivel.
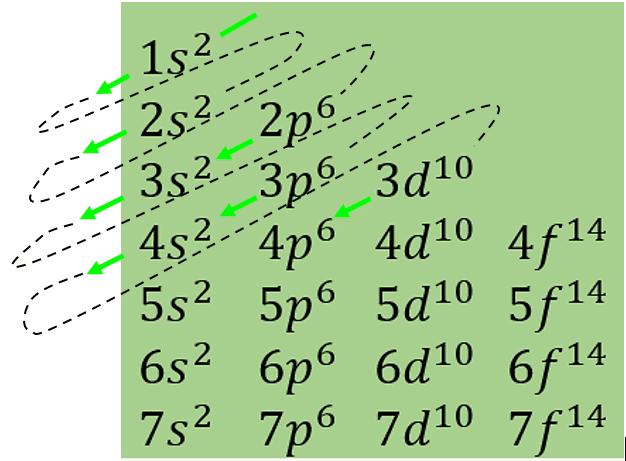
El orden en el cual se llenan los subniveles atómicos en un átomo polielectrónico. Comienza con el orbital 1s y desciende en dirección de las flechas. Así, el orden es como sigue:
1s\to 2s\to 2p\to 3s\to 3p\to 4s\to 3d\to \dotsSiguiente el orden anterior, sumamos cada superíndice hasta llegar al valor de Z para conocer la distribución electrónica de un elemento.
Recuerda que los exponentes o superíndices indican el número máximo de electrones que acepta un orbital. Un átomo en estado neutro tiene la misma cantidad de protones y electrones.
En este sentido, si el número atómico del Kr es 36, debemos sumar cada superíndice hasta alcanzar dicho valor.
La distribución electrónica para el Kr es:
1{s}^{2}, 2{s}^{2}, 2{p}^{6}, 3{s}^{2}, 3{p}^{6}, 4{s}^{2}, 3{d}^{10}, 4{p}^{6}
La respuesta correcta es la opción C.
Reactivo 2
¿Cuál es el número máximo de electrones que pueden existir en el nivel energético 3?
- 16
- 18
- 36
- 38
- 32
Solución:
Siguiendo la imagen de los niveles y subniveles de energía
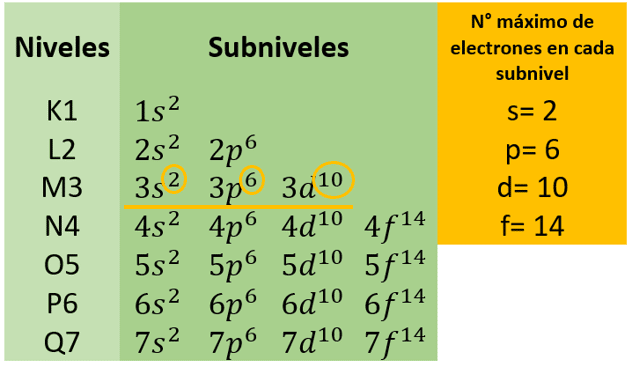
Se observa que el número máximo de electrones que se encuentra en el nivel energético 3 es igual a 18 ( 2+6+10).
Respuesta correcta opción B.
Reactivo 3
Indique la configuración de los electrones de valencia del yodo (I)
- 3{d}^{10}, 4{d}^{10}, 4{f}^{14}
- 1{s}^{2}, 2{p}^{6}, 3{d}^{10}, 4{f}^{14}, 5{p}^{5}
- 5{s}^{2}, 5{p}^{5}
- 5{p}^{5}
- Ninguna de las anteriores
Solución:
La capacidad para reaccionar de los elementos está determinada, en gran parte, por los electrones en su nivel de energía más externo, es decir, los electrones de valencia; ya que ellos serán los encargados de establecer los enlaces con otros átomos.
Los electrones de valencia, para los elementos representativos, son los que se encuentran en el nivel de energía más alto.
La configuración electrónica del I es:
1{s}^{2}, 2{s}^{2}, 2{p}^{6}, 3{s}^{2}, 3{p}^{6}, 4{s}^{2}, 3{d}^{10}, 4{p}^{6}, 5{s}^{2}, 4{d}^{10}, 5{p}^{5}En su distribución electrónica podemos observar que el nivel de energía más alto es el 5, por lo tanto, la configuración electrónica para los electrones de valencia del yodo es:
5{s}^{2}, 5{p}^{5}La respuesta correcta es la opción C.
Reactivo 4
¿Cuántos enlaces y de qué tipo se encuentran en el acetato de sodio (C{H}_{3}-CO{O}^{+}Na) ?
- 6\sigma +1\pi +1 iónico
- 4\sigma +3\pi +1 iónico
- 5\sigma +2\pi +1 iónico
- 6\sigma +2 iónicos
- 7\sigma +1 iónico
Solución:
Para conocer los tipos de enlaces presentes debemos escribir la fórmula desarrollada del compuesto.
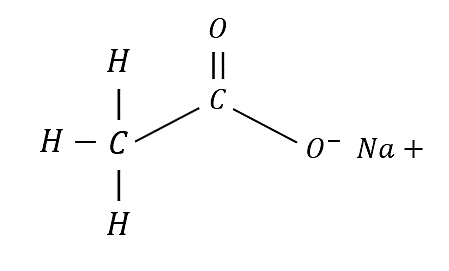
De esta manera se visualiza que los enlaces presentes son:
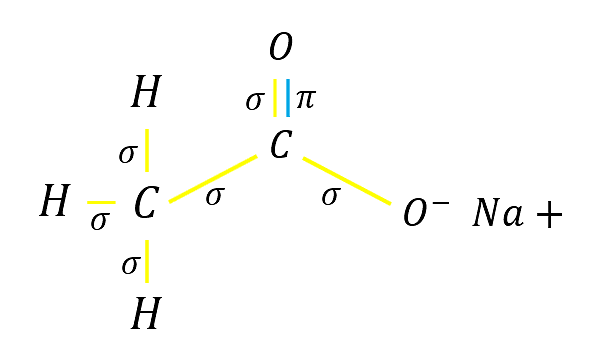
Y un enlace iónico entre el oxígeno y el sodio
Recuerda que:
- Los enlaces sigma \left(\sigma \right) son los enlaces sencillos establecidos en las moléculas orgánicas.
- Los enlaces pi \left(\pi \right) se encuentran formando uno de los enlaces, en los dobles enlaces.
- Los enlaces iónicos se establecen entre átomos con cargas opuestas.
En el acetato de sodio los tipos de enlaces que hay y son cantidad son:
- 6 enlaces sigma
- 1 enlace pi
- 1 enlace iónico
La respuesta correcta es la opción A
Reactivo 5
El agua tiene un punto de ebullición muy elevado, esto se debe a:
- La formación de puentes de hidrógeno entre sus moléculas.
- La estructura tetraédrica de la molécula.
- Su constante de ionización.
- Sus enlaces no polares
- Sus enlaces iónicos
Solución:
El comportamiento particular del agua se debe a su estructura molecular. Formada por un átomo de oxígeno y dos átomos de hidrógeno. En ella, los dos pares de electrones compartidos entre ambos elementos, resultan atraídos con mayor fuerza por el átomo de oxígeno, ya que tiene una mayor electronegatividad.
Los átomos que constituyen la molécula de agua se unen mediante enlaces covalentes polares. Mientras que las moléculas de agua se unen entre ellas estableciendo puentes de hidrógeno gracias al polo negativo (área del oxígeno) y los polos positivos (área de los hidrógenos).
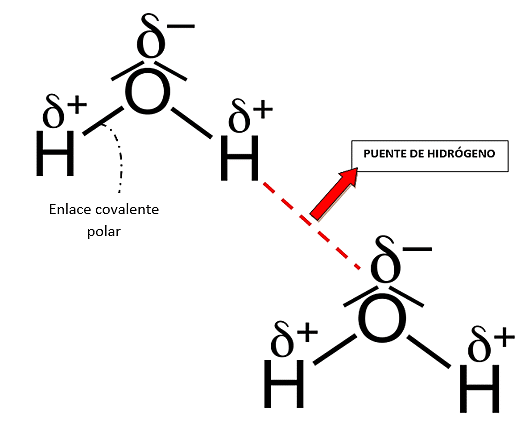
La respuesta correcta es la opción A.
Reactivo 6
Indique cuál de las siguientes cantidades se aproxima más al pH de una solución que tiene una concentración, en moles por litro, de iones hidrógeno \left({H}^{+}\right) de 2\times {10}^{-8}
- 8.2
- 8.3
- 5.6
- 7.3
- 7.7
Solución:
El pH es una medida de la acidez de una solución. Para conocerlo se utiliza la fórmula:
pH= -\mathrm{log}\left[{H}_{3}{O}^{+}\right]
La concentración de hidrogeniones que nos da el enunciado es 2\times {10}^{-8} . Se sustituye el valor dentro de la fórmula:
pH= -\mathrm{log}\left[2\times {10}^{-8}\right]
pH=7.69
pH=7.7
EL pH indicado tiene un valor de 7.7
La respuesta correcta es la opción E.
Reactivo 7
El ácido sulfúrico {H}_{2}S{O}_{4} tiene una densidad de 1.3 g/ml, si queremos preparar un litro de solución 1 molar ¿Qué volumen deberemos tomar del ácido y aforarlo con 1 litro de agua?
- 37.69 ml
- 75.38 ml
- 150.76 ml
- 98 ml
- 49 ml
Solución:
La densidad de una sustancia es la relación que existe entre su masa y volumen \left(\frac{m}{v}\right) . Es un valor constante para cada sustancia a temperatura y presión constante. Se puede utilizar para conocer el volumen de una sustancia a partir de la masa.
En este caso la utilizaremos para conocer los ml de ácido sulfúrico necesarios para preparar 1 litro de solución de concentración 1M.
Primero, calculamos el peso molecular del compuesto {H}_{2}S{O}_{4} :
- H: 1 \times 2=2
- S:32 \times 1=32
- O:16\times 2=64
PM {H}_{2}S{O}_{4}=2+32+64=98 g/mol
PM {H}_{2}S{O}_{4}=98 g/mol
Como el ácido sulfúrico se encuentra concentrado, para conocer los ml necesarios para preparar un litro de solución, se tiene que dividir la masa del compuesto entre su densidad:
ml {H}_{2}S{O}_{4} necesarios: \frac{98 g}{1.3 g/ml}=75.38 ml
Para preparar 1 L de solución de ácido sulfúrico con una concentración 1M, se deben tomar 75.38 ml de {H}_{2}S{O}_{4} concentrado y aforarlo con 1 litro de agua.
Respuesta correcta opción B.
Reactivo 8
Indique cuál de las siguientes cantidades es el más cercano al valor de la constante de equilibrio de la siguiente reacción:
2S{O}_{3}\leftrightarrow 2S{O}_{2}+{O}_{2}Concentraciones en el equilibrio:
S{O}_{3}=0.94 M S{O}_{2}=0.06 M {O}_{2}=0.54- 3.4 \times {10}^{-2}
- 2.9 \times {10}^{-2}
- 6.9 \times {10}^{-2}
- 4.54\times {10}^{-2}
- 2.2\times {10}^{-3}
Solución:
La experimentación ha comprobado la conversión incompleta de algunas sustancias, a pesar de disponer de todo el tiempo necesario para que la reacción se lleve a cabo. La razón, es que en algunas reacciones los productos formados comienzan a reaccionar químicamente entre sí en un proceso inverso regenerando las sustancias reaccionantes.
Por lo tanto, se levanta un obstáculo para la conversión completa de los reactantes a productos porque se presenta la siguiente situación:
A+B\rightleftarrows C+D
La flecha en ambas direcciones quiere decir que se está dando una reacción directa, pero también una reacción inversa hacia la formación de reactantes:
Reacción directa: A+B \to C+D
Reacción inversa: A+B\leftarrow C+D
Cuando se colocan los reactivos, la reacción va a transcurrir por un tiempo determinado hasta que se alcanza un punto medio de transformación. La cantidad de producto formado, se iguala a la cantidad de reactivos formados. Estado que se conoce como equilibrio químico.
La expresión matemática para la constante de equilibrio (Kc) es la siguiente:
Kc= \frac{{\left[C\right]}^{c} {\left[D\right]}^{d}}{{\left[A\right]}^{a} {\left[B\right]}^{b}}
Donde {\left[A\right]}^{a}, {\left[B\right]}^{b}, {\left[C\right]}^{c} y {\left[D\right]}^{d} son las concentraciones molares de las especies químicas que participan en la reacción.
Mientras que, a, b, c y d son los exponentes iguales al coeficiente que cada una de las especies químicas tiene en la ecuación.
En resumen, la constante de equilibrio para una reacción es igual a la división del resultado de multiplicar la concentración en equilibrio de los productos elevados al coeficiente que tienen en la ecuación entre el resultado de multiplicar la concentración en equilibrio de los reactantes elevados al coeficiente que poseen en la reacción.
En este sentido, dada la reacción:
2S{O}_{3}\leftrightarrow 2S{O}_{2}+{O}_{2}
Y las concentraciones molares en equilibrio:
- S{O}_{3}=0.94 M
- S{O}_{2}=0.06 M
- {O}_{2}=0.54
Sustituimos los valores en la expresión:
Kc= \frac{{\left[S{O}_{2}\right]}^{2} {\left[{O}_{2}\right]}^{1}}{{\left[S{O}_{3}\right]}^{2} } Kc= \frac{{\left[0.06\right]}^{2} \left[0.54\right]}{{\left[0.94\right]}^{2} } Kc= \frac{1.944 \times {10}^{-3}}{0.8836 }=2.2 \times {10}^{-3} Kc=2.2 \times {10}^{-3}La respuesta correcta es la opción E.
Reactivo 9
Propiedad que sirve para medir el calor absorbido o liberado por una reacción química a presión constante.
- Energía libre de Gibbs
- Calorías
- Entalpía
- Entropía
- Calor específico
Solución:
La ganancia o pérdida de energía calórica que tiene lugar en un proceso se relaciona en forma directa con el contenido energético que presentan las especies químicas, antes y después del cambio.
La entalpía es simbolizada con la letra H y se define como el contenido calórico de una especie química.
La medición de la entalpía se lleva a cabo a través de los cambios energéticos producidos en un proceso, y no se puede medir de forma directa, es por ello que depende de la variación calórica.
La respuesta correcta es la opción C.
Química orgánica
Reactivo 1
Indique cuántos átomos de carbono se encuentran en los estados de hibridación sp, s{p}^{2} y s{p}^{3} en el compuesto 2,9-decadieno, 4-ona, 6-ino
- 2sp. 5s{p}^{2}, 3s{p}^{3}
- 2sp, 4s{p}^{2}, 4s{p}^{3}
- 3sp, 5s{p}^{2}, 2s{p}^{3}
- 4sp, 4s{p}^{2}, 2s{p}^{3}
- Ninguno de los anteriores
Solución:
Los orbitales híbridos s{p}^{3} del carbono son aquellos que se encuentran formando enlaces simples, es decir, poseen solo un enlace sigma.
Los orbitales híbridos s{p}^{2} , son aquellos que se encuentran formando dobles enlaces, poseen un enlace pi y un enlace sigma.
Los orbitales híbridos sp se encuentran en los triples enlaces carbono – carbono y poseen un enlace sigma y nos pi.
La estructura del compuesto 2,9-decadieno, 4-ona, 6-ino es:
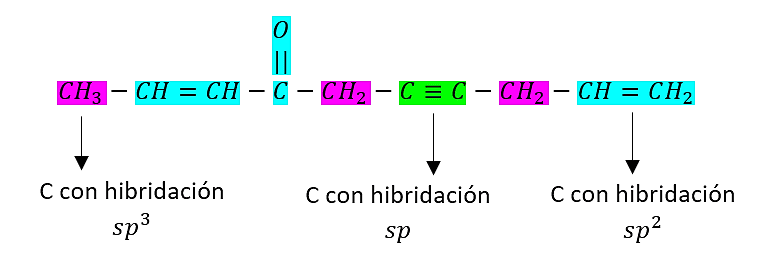
En su estructura se observa la presencia de:
- 2 átomos de carbono con hibridación sp
- 5 átomos de carbono con hibridación s{p}^{2}
- 3 átomos de carbono con hibridación s{p}^{3}
La respuesta correcta del enunciado es la opción A.
Reactivo 2
¿Cuántos enlaces Carbono – Carbono del tipo \sigma y cuántos del tipo \pi existen en la molécula 1, 3 hexadieno5-ino?
- 2\sigma y 7\pi
- 10\sigma y 8\pi
- 5\sigma y 4\pi
- 4\sigma y 7\pi
- 0\sigma y 9\pi
Solución:
Revisemos la fórmula semidesarrollada de la molécula 1, 3 hexadieno5-ino:
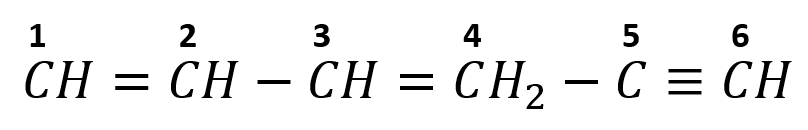
Como su nomenclatura lo indica es una molécula de 6 carbonos que cuenta con dos dobles enlaces y un triple enlace.
Los enlaces sencillos son enlaces sigma, los enlaces dobles poseen un enlace sigma y uno pi y los enlaces triples poseen dos enlaces pi y uno sigma.
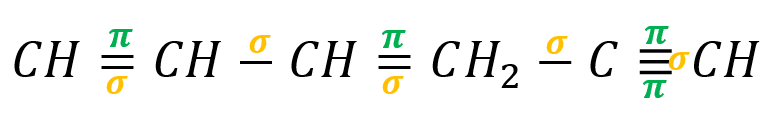
En la molécula 1, 3 hexadieno5-ino tenemos un total de:
- 5 enlaces sigma
- 4 enlaces pi
La respuesta correcta es la opción C.
Reactivo 3
¿Qué grupo funcional es común para aldehídos, cetoNas y azúcares?
- Carboxilo
- Éter
- Carbonilo
- Alcohol
- Aldol
Solución:
El grupo funcional carbonilo (C=O) es común para los aldehídos (ubicado en alguno de los extremos de la molécula) y las cetonas (se ubican en el centro de la molécula). Los azúcares se dividen aldosas y cetosas porque, en efecto, poseen un grupo funcional carbonilo en forma de cetona o aldehído.
La respuesta correcta es la opción C.
Reactivo 4
¿Qué grupo funcional forma un enlace peptídico?
- Un éster
- Un anhídrido
- Un glucósido
- Una amina secundaria
- Una amida
Solución:
Los aminoácidos pueden formar polipéptidos y proteínas uniéndose de forma covalente mediante un enlace amida. El enlace amida se forma entre el grupo α-carboxilo de un aminoácido y el grupo α-amino de otro. Se conoce con el nombre de enlace peptídico.
La respuesta correcta es la opción E.
Reactivo 5
¿Qué compuesto al reducirlo produce un alcohol primario y al oxidarlo un ácido orgánico?
- Un alcano
- Un anhídrido
- Una cetona
- Un aldehído
- Un alqueno
Solución:
El grupo carbonilo ( C=O ) es quien rige el comportamiento químico de los aldehídos (y las cetonas).
La adición de reactivos de Grignard es una reacción que ejemplifica la formación de un alcohol primario a partir de la reducción de un aldehído, en específico la reducción del aldehído metanal.
Los aldehídos se diferencian de las cetonas gracias a su facilidad para oxidarse. La oxidación de un aldehído con mezcla cromosulfúrica en caliente, con el reactivo de Tollens y con el reactivo de Fehling, todas originan un ácido orgánico mediante la oxidación de un aldehído.
La respuesta correcta es la opción D.
Reactivo 6
¿Cuál de las siguientes moléculas presenta resonancia?
- Una hexosa
- El ciclohexano
- El etileno
- El acetileno
- El 1,3,5-ciclohexatrieno
Solución:
Resonancia o mesomería
La formación de una molécula implica que todos los átomos que la integran deben acercarse entre sí para establecer los enlaces a una distancia mínima que les brinde estabilidad.
Esta distancia óptima, que separa a los dos núcleos de los átomos que forman una molécula se llama longitud de enlace.
Para la mayoría de las moléculas orgánicas la distribución de enlaces solo es posible de una manera. Pero, en algunas ocasiones surge un estado interesante. Ciertas moléculas no pueden ser representadas por una única estructura. Por lo tanto, ninguna de las dos estructuras es correcta por sí misma, y la verdadera estructura es intermedia entre las dos.
Un ejemplo, el benceno o 1,3,5-ciclohexatrieno existe en una forma intermedia, híbrido, entre las siguientes estructuras:
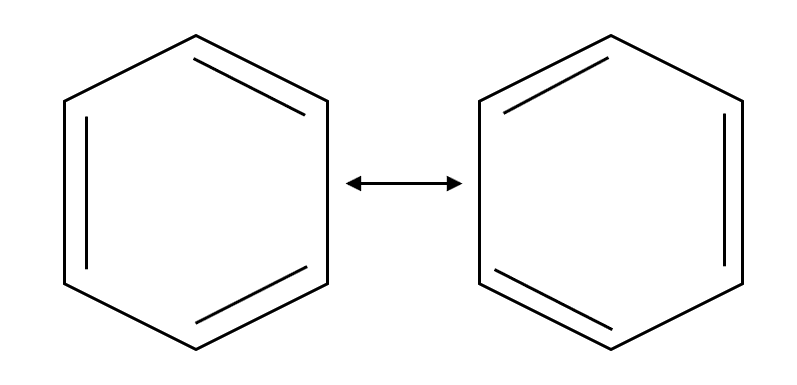
Formas resonantes del benceno.
Los seis enlaces C-C de los compuestos aromáticos, como el benceno, son equivalentes. Es por ello que la mejor forma para representarlo es como un híbrido de dos formas resonantes. Aunque una forma resonante individual parece implicar que el benceno tiene alternadamente enlaces sencillos y dobles, ninguna forma es correcta por sí misma. La verdadera estructura del benceno es un híbrido de las dos formas individuales y los seis enlaces carbono-carbono son equivalentes.
Por ello a menudo vemos el benceno como un híbrido de resonancia representado por la estructura:
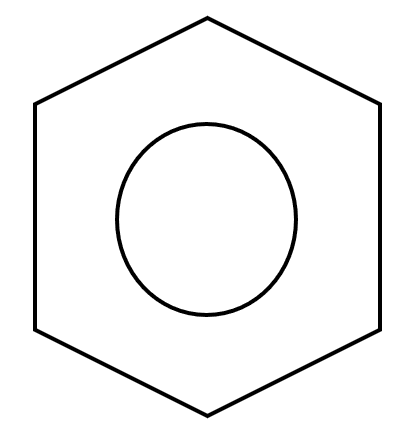
Sin embargo, es importante tener en cuenta que La representación del “círculo” debe utilizarse con cuidado ya que no indica el número de electrones \pi en el anillo.
La respuesta correcta es la opción E.
Reactivo 7
D-aldofuranosa presente en UTP:
- Ribosa
- Glucosa
- Desoxirribosa
- Galactosa
- Uracilo
Solución:
Los carbohidratos se pueden observar en representaciones cíclicas como la fórmula en perspectiva de Haworth.
Las proyecciones de Haworth son una representación convencional en el plano de una molécula de monosacárido ciclada en el que los hidroxilos que se representan a la derecha de la cadena en una proyección de Fischer se muestran por debajo del plano en una proyección de Haworth.
Cuando se cicla un monosacárido en solución, se forman anillos estables, los cuales pueden ser de 5 o 6 lados:
- Los monosacáridos de 5 carbonos forman anillos de cinco lados similares al furano, por eso se nombran como furanosa.
- Los monosacáridos de 6 carbonos forman anillos semejantes al pirano, por ello se les otorga el nombre de piranosa.
El enunciado explica que se trata de una D-aldofuranosa presente en el UTP.
La uridina trifosfato (UTP), es un nucleótido pirimidínico que forma parte del ácido ribonucleico. El nucleótido está formado por una base nitrogenada (que en este caso es el uracilo), una azúcar y un grupo fosfato.
El azúcar que se encuentra presente en los nucleótidos es una ribosa, la cual es una aldopentosa que forma anillos tipo furanosa.
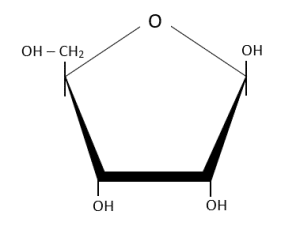
Representación cíclica de la ribosa.
La respuesta correcta es la opción A.
Reactivo 8
Familia de moléculas orgánicas hidrosolubles que son la fuente principal de energía y esqueletos de carbono, para la mayoría de los seres vivos
- Hidrocarburos
- Ácidos tricarboxílicos
- Triacil-glicéridos
- Carbohidratos
- Vitaminas
Solución:
Los carbohidratos son la principal familia de biomoléculas que se encargan de suministrar energía a nuestro organismo. Por ejemplo, el consumo energético del cerebro depende únicamente de la glucosa, en estados de inanición puede funcionar con cuerpos cetónicos, pero aun así no deja de consumir glucosa.
Los hidratos de carbono son cadenas hidrocarbonadas con grupos hidroxilos (OH) unidos a su cadena por enlaces sencillos.
La respuesta correcta es la opción D.
Reactivo 9
Es un ejemplo de un disacárido
- La fructosa
- La lactosa
- La ribosa
- La glucosa
- La N-acetil glucosamina
Solución:
La lactosa es un ejemplo de disacárido reductor, está conformada por la unión de una \beta -galactosa y una \alpha -glucosa mediante un enlace glucosídico \beta (1\to 4) .
Respuesta correcta opción B.
Reactivo 10
Polisacárido de reserva, presente en vegetales, compuesto por unidades de αD-Glucopiranosa unidas por enlaces glucosídicos α-1,4 y ocasionales ramificaciones α-1,6.
- Quitina
- Lignina
- Almidón
- Celulosa
- Glucógeno
Solución:
Nuestro organismo almacena la glucosa en forma de glucógeno, pero en los vegetales no es así. El polisacárido de reserva energética es el almidón.
Reactivo 11
Indique cuáles de las siguientes aseveraciones son correctas en relación a la estructura de doble hélice del DNA
-
- Dos desoxiribonucleósidos consecutivos en una cadena se unen por enlaces fosfodiéster
- Dos ribonucleósidos consecutivos en la cadena se unen por enlaces fosfodiéster
- La Guanina se aparea con la Citosina por tres puentes de hidrógeno
- La Adenina se aparea con la Uracilo por dos puentes de hidrógeno
- La Guanina se aparea con la Adenina por dos puentes de hidrógeno
- La Adenina se aparea con el Timina por dos puentes de hidrógeno
- 1, 3, 6
- 2, 3, 6
- 1, 4, 5
- 2, 4, 5
- 2, 3, 4
Solución:
Los ácidos nucleicos son sustancias poliméricas constituidas por nucleótidos unidos en una secuencia específica a través de enlaces 3´→ 5´ fosfodiéster. Representados por el ADN y el ARN.
La unidad monomérica de los ácidos nucleicos son los nucleótidos, los cuales están conformados por:
- Una base nitrogenada: purinas o pirimidinas
- Un grupo fosfato
- Una azúcar, siempre es una ribosa. Ya sea, una desoxirribosa en el ADN o una ribosa en el ARN. Cuando el carbono 2 posee un grupo OH es una ribosa, si posee solo un H es una desoxirribosa.
Los desoxirribonucleósidos y ribonucleósidos carecen del grupo fosfato unido a su estructura, es decir, son la unión de la ribosa y la base nitrogenada únicamente.
Importante de la ribosa:
- En el carbono 1 se enlaza la base nitrogenada mediante enlace N-glucosídico, para formar un nucleósido.
- La presencia o ausencia de un OH en el carbono 2 determina si es ribosa o desoxirribosa.
- El OH del C3 del azúcar se enlaza con un próximo nucleótido.
- En el C5 siempre se enlaza el fósforo mediante enlace éster.
La conexión entre las sucesivas unidades monoméricas en los ácidos nucleicos se realiza mediante un residuo fosfato unido al hidroxilo del carbono 5´de una unidad y al hidroxilo 3´de la siguiente. Esto forma un enlace fosfodiéster entre dos residuos de azúcar.
Las bases nitrogenadas se dividen en:
- Purinas: Timina, citosina y uracilo. La timina y la citosina se encuentran en el ADN y el uracilo solo en el ARN.
- Pirimidinas: Adenina y guanina.
El modelo de ADN de Watson y Crick fue un golpe intuitivo que determinó la estructura de doble hélice antiparalela del ácido nucleico, en el que se dieron cuenta que una hélice de doble cadena podía estabilizarse mediante puentes de hidrógeno entre las bases de las cadenas opuestas si las bases se apareaban de una manera concreta: los pares A-T y G-C.
- Citosina y guanina se enlazan por tres puentes de hidrógeno.
- Adenina y timina se enlazan por dos puentes de hidrógeno.
Por lo tanto, a la estructura del ADN se le describe complementariedad, ya que las bases nitrogenadas siempre se enlazan de la manera expuesta.
En vista de ello, podemos concluir que las aseveraciones correctas son:
- Dos desoxiribonucleósidos consecutivos en una cadena se unen por enlaces fosfodiéster (1)
- La Guanina se aparea con la Citosina por tres puentes de hidrógeno (3)
- La Adenina se aparea con el Timina por dos puentes de hidrógeno (6)
La respuesta correcta es la opción A.

