¡Hola aspirante! En este tutorial vamos a desarrollar los reactivos del 108 al 120 correspondientes al área de química para el examen de ingreso a la UAM por las divisiones Ciencias Básicas e Ingeniería y Ciencias Naturales e Ingeniería.

Si aún no los resuelves por tu cuenta, inténtalo primera y luego regresa. La clave para lograr el mayor puntaje es comprender los conceptos detrás de la solución de los reactivos.
A continuación, tienes un resumen de la convocatoria con la información más resaltante.
- Número de convocatorias: Dos al año.
- Fechas de registro: marzo y agosto del 2022
- Oferta académica: 82 carreras
- Divisiones académicas: 6
- Modalidad: en línea
Estructura del examen de ingreso UAM 2022
La prueba de ingreso a la Universidad Autónoma Metropolitana se divide en dos partes: una prueba de aptitud y otra de conocimientos específicos que dependerá de la división a la que pertenezca tu carrera.
La prueba de aptitud contiene reactivos de Razonamiento Verbal y Razonamiento Matemático, los cuales se mantienen para las 6 divisiones en la UAM. El total de reactivos en esta primera parte es de 40.
La segunda parte de la prueba, para las divisiones CBI y CNI, esta compuesta por reactivos de matemáticas, física, química, Razonamiento simbólico-abstracto y Razonamiento Lógico. A grandes rasgos, te dejo un resumen de los temas que se incluyen en la segunda parte.
Química
- Materia
- Estructura del átomo
- Nomenclatura
- Reacciones químicas
Matemáticas
- Aritmética
- Álgebra
- Racionalización
- Geometría euclidiana
- Trigonometría plana
- Geometría analítica
- Cálculo diferencial e integral
Física
- Análisis dimensional
- Cinemática
- Dinámica
- Estática
- Hidrostática
- Electrostática
Resumen de reactivos por cada parte del examen.
| Área | Reactivos | Porcentaje |
|---|---|---|
| Razonamiento verbal | 20 | 25% |
| Razonamiento matemático | 20 | 25% |
| Conocimientos específicos | 40 | 50% |
| Total | 80 | 100% |
Temario de Química para CBI y CNI
Química es una asignatura cuya comprensión depende enormemente de los conceptos teóricos. Estudia a detalle cada uno de los temas y dedica el tiempo suficiente hasta dominarlos.
Materia
- Sustancias puras y mezclas
- Estados de agregación
Estructura del átomo
- Partículas subatómicas fundamentales
- Número atómico, número de masa e isótopos
- Moléculas e iones
- Masa molar y cantidad de sustancia (mol)
Nomenclatura
- Compuestos iónicos
- Compuestos moleculares
- Ácidos y bases
Reacciones químicas
- Ácido – base
- Óxido – reducción
- Combustión
Guía UAM de Química resuelta
Vamos con la solución paso a paso de los reactivos de Química para las divisiones de CBI y CNI de la prueba de ingreso a la Universidad Autónoma Metropolitana.
Reactivo 108: Estados de agregación
El yodo es un elemento que con el aumento de temperatura cambia de estado sólido a estado gaseoso; a este proceso se le conoce como:
- Fusión.
- Condensación.
- Evaporación.
- Sublimación.
- Solidificación.
Solución:
La sublimación es el proceso por el cual las moléculas pasan directamente de la fase sólida a la fase de vapor. Por lo tanto, cuando se eleva la temperatura y bajo un proceso controlado, el yodo sólido se convierte en vapor.
La respuesta correcta es la opción D.
Reactivo 109: Propiedades de los elementos
La densidad de 1.0 g de cobre puro es de 8.94 g/c{m}^{3} . ¿Cuál es la densidad de 100 g de cobre?
- 894 g/c{m}^{3}
- 94 g/c{m}^{3}
- 894 g/c{m}^{3}
- 4 g/c{m}^{3}
- 0894 g/c{m}^{3}
Solución:
La densidad es una relación entre la masa y el volumen de un material y se define como la masa contenida en una unidad de volumen. Mientras mayor sea la cantidad de materia contenida en una unidad de volumen, mayor será la densidad de esa sustancia y viceversa.
La relación masa/volumen es un valor constante para cada sustancia a presión y temperatura constantes, por lo que es útil para identificar una sustancia. Se debe tener presente los cambios de presión y temperatura porque son parámetros que pueden modificar la densidad.
La densidad del cobre puro es 8.94 g/c{m}^{3} y en 100 g de Cu será la misma.
En este caso la respuesta correcta es la opción B.
Reactivo 110: Modelo atómico
Un átomo neutro de fósforo {}_{15}{}^{31}P tiene _________ protones, _________ neutrones y __________ electrones.
- 15 – 16 – 15
- 15 – 31 – 15
- 15 – 31 – 16
- 16 – 15 – 31
- 31 – 16 – 15
Solución:
El P posee un número atómico (Z) igual a 15, lo que indica la cantidad de protones.
El número másico o masa atómica es de 31 y representa la cantidad de neutrones y protones en el núcleo atómico. Para conocer la cantidad de neutrones, le restamos el número atómico a la masa atómica del elemento:
N=A-Z
N=31-15=16
La cantidad de neutrones es igual a 16. Y como el enunciado especifica que el P se encuentra en estado neutro, la cantidad de protones y electrones es la misma. Por lo tanto, el número de electrones es igual a 15.
- Protones = 15
- Neutrones = 16
- Electrones = 15
La respuesta correcta es la opción A.
Reactivo 111: Isótopos
Los isótopos son átomos de un mismo elemento con:
- Igual número de neutrones e igual número de masa.
- Igual número de protones y diferente número de masa.
- Igual número de protones e igual número de neutrones.
- Igual número de nucleones y diferente número de masa.
- Igual número de protones y diferente número atómico.
Solución:
Los átomos de un elemento mantienen un número fijo de protones, pero pueden variar en cuanto al número de neutrones. Solamente 22 de los 119 elementos conocidos están formados por un sólo tipo de átomo.
La mayoría de los elementos químicos en la naturaleza están constituidos por diferentes tipos de átomos debido a que no tienen el mismo número de neutrones. Los elementos que tienen igual número de protones, pero diferente número de neutrones se denominan isótopos. Algunos isótopos son naturales y otros son artificiales.
Esto quiere decir que los isótopos poseen igual número de protones y diferente número de masa. Por ejemplo, los isótopos del neón:
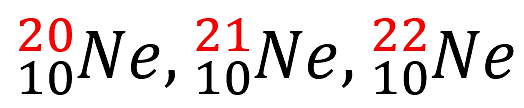
En cada uno de ellos, solamente varía la cantidad de neutrones y se refleja en el número de masa.
La respuesta correcta es la opción B.
Reactivo 112: Modelo atómico
El número de electrones del {{}_{7}{}^{14}N}^{+1} es __________.
- 6
- 7
- 8
- 14
- 15
Solución:
Como se dijo con anterioridad, en un átomo neutro la cantidad de electrones será igual a la cantidad de protones. Pero, como se trata de un átomo cargado positivamente (+1). Al número atómico, se le debe restar el valor de electrones perdidos, representados en la carga positiva adicional, para obtener el número de electrones.
N° e-{N}^{+1}=7-1=6
El número de electrones para el {{}_{7}{}^{14}N}^{+1} es igual a 6. La respuesta correcta es la opción A.
Reactivo 113: Modelo atómico
En la formación de un compuesto iónico, el catión es un átomo o molécula que ha _________ uno o más de sus __________ de valencia.
- Perdido – protones.
- Perdido – electrones.
- Ganado – electrones.
- Compartido – electrones.
- Ganado – protones.
Solución:
Los átomos que pierden o ganan electrones se llaman iones. Cuando los átomos pierden electrones se convierten en iones con carga positiva, llamados cationes. Los electrones que pierden se encuentran en la última capa de energía (valencia).
Por lo tanto, el enunciado se responde de la siguiente manera:
En la formación de un compuesto iónico, el catión es un átomo o molécula que ha perdido uno o más de sus electrones de valencia. La respuesta correcta es la opción B.
Reactivo 114: Estequiometría
Se tiene carbonato de calcio, cuya fórmula química es CaC{O}_{3} . El peso atómico del carbono es 12 g, el del oxígeno es 16 g y el del calcio es 40 g. La cantidad de gramos de cada elemento en 1000 g de CaC{O}_{3} es ______ de carbono, _______ de oxígeno y ________ de calcio.
- 12g – 48 g – 40 g
- 48 g – 12 g – 48 g
- 160 g – 80 g – 200 g
- 120 g – 480 g – 400 g
- 130 g – 40 g – 100 g
Solución:
Para conocer la cantidad en gramos de cada elemento que conforma 1000 g de CaC{O}_{3} , primero se debe multiplicar el peso atómico de cada elemento por la cantidad de moléculas presentes en el compuesto:
- C: 1\bullet 12=12 g
- O: 3 \bullet 16=48 g
- Ca: 1 \bullet 40=40 g
Al conocer la porción real en gramos de cada elemento del compuesto, multiplicamos los valores por 100:
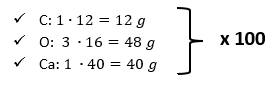
Los siguientes valores representan la cantidad en gramos de cada elemento contenidos en 1000 g de CaC{O}_{3} :
- C = 120 g
- O = 480 g
- Ca = 400 g
La cantidad de gramos de cada elemento en 1000 g de CaC{O}_{3} es 120 g de carbono, 480 g de oxígeno y 400 g de calcio. La respuesta correcta es la opción D.
Reactivo 115: Modelo atómico
Para el cloro ( Cl ) y el ion cloruro ( C{l}^{-} ) puede afirmarse que ambos tienen:
- Mismo número de protones.
- Mismo número de neutrones.
- Mismo número de electrones.
- Diferente número de protones.
- Diferente número de neutrones.
- Diferente número de electrones.
- 1, 2, 6
- 2, 3, 4
- 1, 3, 5
- 2, 5, 6
- 1, 2, 3
Solución:
Para el Cl y el ion cloruro podemos afirmar que poseen:
- Mismo número de neutrones y protones.
- Diferente número de electrones, debido a que el ion tiene un electrón adicional.
La respuesta correcta es la opción A.
Reactivo 116: Alquinos
Acetileno es el nombre común del compuesto {C}_{2}{H}_{2} . ¿Cuál es su nombre químico?
- Metino
- Etino
- Etano
- Eteno
- Meteno
Solución:
Los alquinos son hidrocarburos alifáticos que poseen un triple enlace entre dos átomos de carbono consecutivos. También se conocen como hidrocarburos acetilénicos ya que el primer integrante de esta clasificación es el acetileno o etino HC≡CH.
La respuesta correcta es la opción B.
Reactivo 117: Compuestos químicos
Relaciona las fórmulas de los compuestos de la columna izquierda con sus respectivos nombres en la columna derecha:

- 1b, 2a, 3e
- 1b, 2e, 3c
- 1c, 2f, 3b
- 1b, 2f, 3c
- 1a, 2c, 3d
Solución:
Procedemos a establecer la relación correspondiente
- Ácido sulfúrico: {H}_{2}S{O}_{4} . Relación 1b
- Ácido sulfuroso: {H}_{2}S{O}_{3} . Relación 2e
- Ácido sulfhídrico: {H}_{2}S . Relación 3c
La respuesta correcta es la opción B.
Reactivo 118: Reacciones de neutralización
Completa la siguiente reacción: {H}_{2}S{O}_{4}+2NaOH \to ______________ + ____________
- N{a}_{2}O+S{O}_{2}
- N{a}_{2}S{O}_{4}+2{H}_{2}O
- N{a}_{2}S+{H}_{2}O
- NaOH+{H}_{2}O
- Na+{H}_{2}O
Solución:
Para conocer la respuesta debemos evaluar los reactantes, si nos fijamos con detalle, observamos que están reaccionando un ácido ( {H}_{2}S{O}_{4} ) y una base ( NaOH ). Cuando se combina un ácido y una base se genera una reacción de neutralización, dando como producto sal y agua.
![]()
Entre las opciones, el compuesto N{a}_{2}S{O}_{4} es una sal y está acompañado de 2{H}_{2}O agua.
La opción B es la que contiene la respuesta adecuada para la reacción dada en el enunciado y queda formulada de la siguiente manera:
{H}_{2}S{O}_{4}+2NaOH \to N{a}_{2}S{O}_{4}+2{H}_{2}O
Reactivo 119: Números de oxidación
El número de oxidación del azufre en el sulfito de sodio, NaS{O}_{3} es: _________
- +4
- -4
- -6
- +2
- +6
Solución:
Establecemos los números de oxidación para cada elemento:
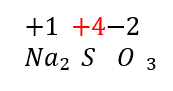
El azufre posee un número de oxidación +4. La respuesta correcta es la opción A.
Reactivo 120: Reacciones de combustión
De las siguientes reacciones ¿Cuáles son de combustión?
- 1{C}_{4}{H}_{10}+12{O}_{2} \to 8C{O}_{2}+10{H}_{2}O+energía
- 2Mn{O}_{4}^{-}+5{H}_{2}{C}_{2}{O}_{4}+6 {H}^{+} \to 2M{n}^{+3}+10C{O}_{2}+8{H}_{2}O
- C{H}_{4}+2{O}_{2} \to C{O}_{2}+2{H}_{2}O+890 kJ/mol
- 2Mn{\left(CO\right)}_{5}+7{O}_{2} \to 2Mn{O}_{2}+10C{O}_{2}
- 6C{O}_{2}+6{H}_{2}O+energía solar \to {C}_{6}{H}_{12}{O}_{6}+6{O}_{2}
- 1 y 3
- 1 y 4
- 2 y 5
- 1 y 5
- 2 y 4
Solución:
En todas las reacciones de combustión se manifiestan cambios de energía que puede ser absorbida o liberada en forma de calor, luz, electricidad y/o mecánica. Cuando una reacción libera energía en forma de calor o energía térmica al entorno, se dice que la reacción de combustión es exotérmica; y cuando la energía es extraída del entorno para que se efectúe, la reacción de combustión es endotérmica.
Entre las opciones presentes en el enunciado, podemos reconocer que las reacciones 1 y 3:
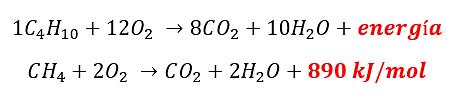
Liberan energía y corresponde a reacciones de combustión.
La respuesta correcta es la opción A.

