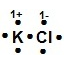¡Hola! A continuación queremos continuar con el estudio del módulo de química que encontramos en la guía Exani II y queremos que estudies junto a nosotros. En caso de que hayas llegado a esta parte de nuestra guía resuelta y aún no hayas desarrollado la primera parte, acá abajo encontrarás un enlace directo a la primera parte.

Aquí tienes un resumen de los aspectos más relevantes de este examen:
- Desarrollo: Ceneval
- Examen de admisión: Exani II
- Reactivos: 168
- Tipo: Opción múltiple
- Duración: 4 horas y media
- Modalidades: Presencial, en línea y desde casa.
Estructura del Exani II
Como abrebocas previo al desarrollo de la guía de ejercicios de Química del examen, consideramos muy importante que tengas clara cuál es la estructura del Exani II.
ten presente que esta prueba llevada a cabo por Ceneval aborda las áreas que acá te mostramos:
| Área | Reactivos |
|---|---|
| Habilidades y conocimientos | |
| Pensamiento matemático | 30 |
| Comprensión lectora | 30 |
| Redacción indirecta | 30 |
| Módulos de conocimientos específicos | |
| Módulo 1 | 24 |
| Módulo 2 | 24 |
| Subtotal de reactivos | 138 |
| Diagnóstico | |
| Inglés | 30 |
| Total de reactivos | 168 |
Tabla Estructura Exani II
Debido a que en este 2021 la estructura del Exani II fue cambiada, es importante conocer cuáles son las áreas de estudio que fueron eliminadas y cuáles fueron integradas al mismo.
Por eso, te invitamos a ver los detalles referentes a este cambio a través de nuestro siguiente post, donde te explicamos todo de la mejor manera:
Ejercicio 11: Tabla periódica
Si el magnesio se encuentra en el grupo 2 de la tabla periódica de los elementos, su átomo tiene 2…
- Niveles de energía
- Electrones de valencia
- Electrones en total
- Protones en su núcleo
Solución:
Los grupos de la tabla periódica indican los electrones de valencia de un elemento. Si el magnesio se encuentra en el grupo dos, quiere decir que su átomo tiene 2 electrones de valencia.

Las valencias de los elementos, en su expresión más estable, pueden cambiar sus características de acuerdo con el elemento que se combinan. Por ejemplo, el grupo VII de los halógenos, su valencia principal es -1; es decir su naturaleza química lo induce a ganar un electrón. La configuración del átomo sin combinarse contiene 7 electrones en la última capa, entre los orbitales s y p; al ganar un electrón completa la tercera pareja de los orbitales p.
Aparentemente, los átomos buscan la configuración electrónica más estable a través de vías alternativas, como la pérdida o la ganancia de electrones. En el caso del grupo I es más fácil suponer que su tendencia será perder un electrón que ganar 7, necesarios para completar los orbitales s y p. Contrario a lo que sucede con los elementos del grupo VII.
Existen variaciones, sobre todo en el caso de los elementos de transición, sus valencias pueden ser muy diferentes durante las interacciones químicas. Ellos pueden originar complejos moleculares que involucran a muchos de sus electrones; sin embargo, es de esperarse debido a la amplitud de las últimas capas electrónicas de estos elementos y la escasa diferencia energética entre sus subniveles (orbitales d y f).
La respuesta correcta es la opción B.
Ejercicio 12: Números de oxidación
¿Cuáles son las valencias del Cl en los compuestos \mathrm{HCl}, \mathrm{HClO}, \mathrm{HClO}_{2}, \mathrm{HClO}_{3} \mathrm{y} \mathrm{HClO}_{4} respectivamente?
- \pm 1,-3,-5,-7
- \pm 1,-2,-3,-4
- \pm 1,+2,+3,+4
- \pm 1,+3,+5,+7
Solución:
La suma algebraica de los números de oxidación o valencia de cada elemento presente en el compuesto debe ser igual a cero.
+1 H-1 C l Carga neta: +1 -1 = 0
+1 H+1 C l-20 Carga neta: +1 +1 -2 = 0
+1 \mathrm{H}+3 \mathrm{Cl}-2 \mathrm{O}_{2} Carga neta: +1 +3 – (2×2) = 0
+1 \mathrm{H}+5 \mathrm{Cl}-2 \mathrm{O}_{3} Carga neta: +1 +5 – (2×3) = 0
+1 H+7 C l-2 O_{4} Carga neta: +1 +7 – (2×4) = 0
En cada uno de los compuestos podemos ver que el Cl trabaja con las valencias, +1, -1, +3, +5 y +7 respectivamente, indicando que la respuesta correcta es la opción D.
Ejercicio 13: Distribución electrónica de los elementos
¿Qué número de oxidación tiene el elemento que representa la configuración electrónica?
1 s^{2} 2 s^{2} 2 p^{6} 3 s^{2} 3 p^{5}
- -7
- -5
- -2
- -1
Solución:
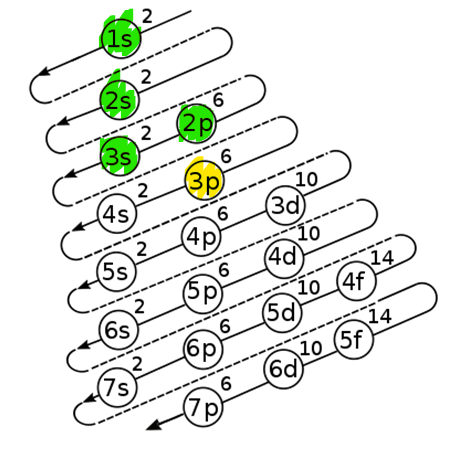
En el esquema de distribución electrónica para ese elemento en particular 1 s^{2} 2 s^{2} 2 p^{6} 3 s^{2} 3 p^{5} , podemos observar que el subnivel 3 p^{6} no se ha llenado completamente y sólo le falta un electrón alcanzar el octeto, por lo tanto, el número de oxidación es -1. La respuesta correcta es la opción D.
Ejercicio 14: Distribución electrónica de los elementos
Si la configuración electrónica del potasio (K) es 1 s^{2} 2 s^{2} 2 p^{6} 3 s^{2} 3 p^{6} 4 s^{1} , se localiza en la familia IA y su número atómico es 19 ¿En cuál nivel se encuentran sus electrones de valencia?
- 1
- 2
- 3
- 4
Solución:
Los electrones de valencia se encuentran en el último nivel energético, es decir su capa más externa. Para el caso del potasio, sus electrones de valencia se encuentran en el nivel 4 según la distribución electrónica 1 s^{2} 2 s^{2} 2 p^{6} 3 s^{2} 3 p^{6} 4 s^{1} .
La respuesta correcta es la opción D.
Ejercicio 15: Formación de enlaces
De acuerdo con la estructura de Lewis, el nitrógeno tiende a ________ electrones.
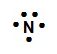
- Perder 3
- Ganar 3
- Perder 5
- Ganar 5
Solución:
La estructura de Lewis es la representación electrónica de una molécula. En ella se coloca el número de electrones que proporciona cada átomo, representado con puntos o líneas, formando parejas. Un elemento que participa en el enlace químico adquiere su estabilidad con la ayuda de los electrones vecinos.
Los átomos pertenecientes a los grupos I, II y III, cuya tendencia evidente es perder electrones, lo hacen concediéndolos como parejas de los electrones de otros átomos más electronegativos. Por otro lado, los elementos del grupo IV, V, VI, VII buscan rodearse de ocho electrones y suelen tomar los electrones de otros elementos menos electronegativos durante el enlace químico.
Según la estructura de Lewis, y cómo el nitrógeno pertenece al grupo 5, el N tiende a ganar 3 electrones para alcanzar su estabilidad electrónica completando su última capa de valencia.
La respuesta correcta es la opción B.
Ejercicio 16: Formación de enlaces
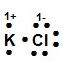
¿Cuál modelo de Lewis corresponde al compuesto iónico KCl?
Solución:
Recordemos que la estructura de Lewis es la representación electrónica de una molécula, la cual proporciona un modelo de cómo los átomos que participan en la reacción comparten electrones. En el compuesto KCl el K posee la tendencia de perder sus electrones y el Cl es un elemento que toma los electrones durante la formación de enlaces para alcanzar su estabilidad electrónica.
La estructura de Lewis para el KCl es:
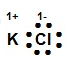
Allí se puede observar cómo el cloro se ha rodeado de ocho puntos (electrones), tomando el electrón del potasio, incrementando su carga negativa -1 y el K ha cedido su electrón quedando con carga positiva +1.
La respuesta correcta es la opción B.
Ejercicio 17: Enlace químico
¿Qué tipo de enlace se presenta en el compuesto \mathrm{NH}_{3} ?
- Iónico
- Metálico
- Covalente polar
- Covalente no polar
Solución:
Un enlace covalente es el que se forma entre dos átomos que comparten un par de electrones. En moléculas idénticas como el \mathrm{O}_{2} los elementos tienen la misma electronegatividad, por lo tanto los electrones permanecerán en el centro del espacio internuclear compartiéndose por igual.
Pero, cuando hay diferencia de electronegatividades los electrones pasarán más tiempo alrededor del elemento con mayor electronegatividad creando un enlace covalente polar, el cual es el caso del \mathrm{NH}_{3} . En donde existe una separación de cargas positivas y negativas, ya que los átomos que participan tienen diferentes electronegatividades; siendo de mayor electronegatividad el N.
La respuesta correcta es la opción C.
Ejercicio 18: Conductividad eléctrica
El cloruro de sodio (NaCl) es un compuesto iónico…
- Insoluble en agua y no conduce la electricidad
- Líquido y en disolución conduce la electricidad
- Sólido y tiene bajos puntos de fusión
- Muy soluble en agua y no conduce la electricidad
Solución:
El NaCl es un compuesto iónico en disolución acuosa. Cuando se encuentra en una disolución se separa en sus iones positivos (Na+) y negativos (Cl-), lo que les confiere la propiedad de conducir la electricidad cuando se aplica una diferencia de potencial en la sustancia a través del uso de electrodos.
Por lo tanto la opción correcta es la B.
Ejercicio 19: Enlace covalente
Seleccione las características físicas de las sustancias con enlace covalente:
- Tienen altos puntos de fusión y ebullición
- Son pobres conductores eléctricos en todas las fases
- Se pueden presentar como sólidos cristalinos
- Existen en los tres estados de agregación
- Sus puntos de fusión y ebullición son bajos
- Fundidos y en disolución acuosa conducen la corriente eléctrica
- 1, 3, 5
- 1, 4, 6
- 2, 3, 6
- 2, 4, 5
Solución:
Las características físicas de una sustancia con enlace covalente corresponde a:
- Son pobres conductores eléctricos en todas las fases, ya que sus electrones están atraídos por los núcleos de los átomos que participan en el enlace
- Existen en los tres estados de agregación (sólido, líquido y gaseoso)
- Sus puntos de ebullición y de fusión son bajos
La respuesta correcta es la opción D.
Ejercicio 20: Enlace químico
¿Cuáles fuerzas se manifiestan con la atracción electrostática entre el extremo positivo de una molécula polar y el negativo de otra similar?
- London
- Maxwell
- Ion-dipolo
- Dipolo-dipolo
Solución:
Las fuerzas dipolo-dipolo son las fuerzas de atracción entre las moléculas polares o compuestos con momento dipolar. Es decir, la atracción electrostática entre un polo positivo y un polo negativo de distintas moléculas que poseen momentos dipolares.
La respuesta correcta es la opción D.