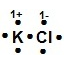Bienvenido nuevamente a nuestra serie de guías resueltas con ejercicios resueltos del Exani II. Si estás buscando prepararte para tu examen de admisión, nosotros estamos decididos a ayudarte. En esta oportunidad, nos concentraremos en el módulo de Físico-Química. En esta nueva versión del Exani de Ceneval, el módulo de Físico-Química es uno de los más exigentes.

Estos son algunos de los detalles más importantes referentes al Exani II:
- Desarrollo: Ceneval
- Examen de admisión: Exani II
- Reactivos: 168
- Tipo: Opción múltiple
- Duración: 4 horas y media
- Modalidades: Presencial, en línea y desde casa.
A partir del verano del 2021, Ceneval, organismo responsable del Exani, implementó una serie de cambios, principalmente enfocado en los reactivos y la estructura de la evaluación. Por tal motivo, es útil que te familiarices con los principales cambios del examen.
[wpipa id=”10740″]
Ten en consideración que el Exani, examen de admisión que aplican muchas de las mejores universidades de México, es dirigido por Ceneval, un organismo independiente a todas las casas de estudio.
Estructura del Exani II
Ya estamos por dar inicio a la resolución de ejercicios del módulo específico de Físico-Química, pero antes, te invitamos a familiarizarte con la estructura de esta prueba.
Dicho esto, en la siguiente tabla puedes ver los detalles:
| Área | Reactivos |
|---|---|
| Habilidades y conocimientos | |
| Pensamiento matemático | 30 |
| Comprensión lectora | 30 |
| Redacción indirecta | 30 |
| Módulos de conocimientos específicos | |
| Módulo 1 | 24 |
| Módulo 2 | 24 |
| Subtotal de reactivos | 138 |
| Diagnóstico | |
| Inglés | 30 |
| Total de reactivos | 168 |
Tabla Estructura Exani II
en vista de todo lo que acabamos de mencionarte con respecto a los cambios que ha tenido el Exani desde el verano de 2021, es necesario que sepas que, los principales cambios consisten en eliminación de algunos módulos de conocimiento del examen, así como la adición de otros que vienen a sustituirlos.
Puedes saber más acerca de la estructura y detalles del Exani II de Ceneval a través de este post que hemos preparado al respecto:
Temario Físico-Química
Para dar pie al abordaje de los reactivos de Físico-Química de la guía del Exani II, es necesario que te familiarices con los temas que acá se abordan.
La Físico-Química es parte de los nuevos módulos específicos que forman parte del Exani II.Por tal razón, acá te dejamos el temario completo para este módulo:
Fundamentos de física y química
- Unidades y magnitudes (sistemas de conversiones)
- Características físicas y químicas de la materia
Materia
- El átomo: partículas subatómicas, número atómico y masa atómica
- Tabla periódica: grupos y periodos, electronegatividad y radio atómico
- Modelos atómicos: Bohr y cuántico
- Configuraciones electrónicas, niveles energéticos, electrones de valencia y número de oxidación
- Estados de agregación, cambios físicos, químicos y de estado
- Leyes de los gases
- Leyes termodinámicas
- Clasificación de reacciones químicas: síntesis, descomposición, desplazamiento simple y doble; óxido-reducción y neutralización
- Balanceo de ecuaciones químicas
- Estequiometría
Fuerza y energía
- Movimiento uniforme
- Leyes de Newton: aplicaciones
- Trabajo, potencia y conservación de la energía mecánica
- Ley de Coulomb
- Corriente eléctrica y ley de Ohm
- Potencia eléctrica y el efecto Joule
- Magnetismo
- Propiedades físicas de las sustancias iónicas, covalentes y metálicas:
- solubilidad, punto de fusión, punto de ebullición y conductividad
¿Qué tan difícil es el módulo de Físico-Química del Exani II?
Una pregunta que muchos se hacen con respecto al examen de admisión, es qué tan difícil es. En respuesta de esto, es necesario que no te compliques la vida, ya que la verdadera dificultad que encontrarás en el Exani II dependerá de tu propia preparación, así que planteate las siguientes preguntas:
- ¿Has estudiado para el examen de admisión?
- ¿Has dedicado tiempo a estudiar para cada módulo o parte del examen?
- ¿Ya dominas las áreas clave del mencionado examen?
Guía Exani II contestada: Físico-Química
Ahora sí es momento de ir directamente a la práctica y dar respuesta a cada uno de los reactivos del módulo específico de Físico-Química del Exani II de Ceneval. Dado que son 22 reactivos, los abordaremos todos en este único post.
Te recomendamos que, antes de ver la respuesta correcta para cada ejercicio, tú mismo intentes resolverlo y luego compares resultados. Considera que dado el nuevo formato del Exani, la modalidad de respuesta en Selección múltiple ofrece 3 opciones diferentes. Puedes informarte mejor en nuestro megapost del Exani II:
Reactivo 1: Modelo atómico
A partir de las definiciones de los griegos y de sus propias observaciones acerca de la materia Dalton estableció en su teoría del átomo…
- Está constituido por partículas con carga positiva y negativa
- Está conformado por un núcleo con carga positiva debido a los protones
- Es la partícula más pequeña de un elemento que conserva sus propiedades
- Está conformado por un núcleo con neutrones, protones y electrones alrededor
Solución:
El filósofo griego Demócrito, en el siglo V a.C, expresó la idea de que toda la materia estaba conformada por la unión de muchas partículas pequeñas e indivisibles a las que llamó átomos (que hace alusión a indestructible o indivisible). Su opinión no fue aceptada por las mentes brillantes de la época, cómo Aristoteles y Platón, sin embargo se mantuvo a través de los años.
El científico Jhon Dalton, en el año 1808, trabajó sobre las ideas de Demócrito. Y formuló una definición precisa para las unidades con las que está formada la materia. Los trabajos de Dalton marcaron el principio de la era moderna de la química estableciendo la teoría del átomo, la cual especifica que el átomo es la partícula más pequeña de un elemento que conserva sus propiedades.
Su hipótesis también incluye que:
- Los elementos están formados por un sólo tipo de átomos
- Los átomos de un elemento tienen la misma masa, tamaño y propiedades químicas
- Cada elemento tiene átomos diferentes de otros elementos
- Durante las reacciones químicas los átomos nunca se destruyen, crean o eliminan. Sólo se combinan, reordenan o separan
La respuesta correcta es la opción C.
Reactivo 2: Modelo atómico
Si el elemento químico oro (Au) posee una masa atómica de 197 y un número atómico de 79 ¿Cuántos neutrones contiene en su núcleo?
- 79
- 118
- 197
- 276
Solución:
La cantidad de neutrones presentes en el núcleo del átomo se conoce al restar el número atómico a la masa atómica.
N^{\circ} \text { de neutrones }=\text { masa atómica }-Z
N^{\circ} \text { de neutrones }=197-79
N^{\circ} \text { de neutrones }=118
La respuesta correcta es la opción B.
Reactivo 3: Distribución electrónica de los elementos
A partir de su configuración electrónica 1 s^{2} 2 s^{2} 2 p^{6} 3 s^{2} , este elemento se encuentra en el periodo ___ y tiene 2 electrones de valencia.
- 1
- 2
- 3
- 6
Solución:
La estructura atómica de un elemento en particular, dependerá del número de niveles y subniveles energéticos que presente; este depende, a su vez, del número de electrones que contenga. La ubicación de un elemento en la tabla periódica se puede conocer por la parte final de su configuración electrónica, es decir, para el elemento del enunciado la configuración electrónica es:
1 s^{2} 2 s^{2} 2 p^{6} 3 s^{2}
Si queremos saber el período en el que se encuentra dentro de la tabla periódica, tomamos en consideración la parte final de su configuración:
3 s^{2}
Dónde:
- 3 representa el nivel energético (período)
- s es el subnivel energético
- 2 es la cantidad de electrones de ese subnivel
La respuesta correcta es la opción C.
Reactivo 4: Tabla periódica
Si el magnesio se encuentra en el grupo 2 de la tabla periódica de los elementos, su átomo tiene 2…
- Niveles de energía
- Electrones de valencia
- Electrones en total
- Protones en su núcleo
Solución:
Los grupos de la tabla periódica indican los electrones de valencia de un elemento. Si el magnesio se encuentra en el grupo dos, quiere decir que su átomo tiene 2 electrones de valencia.

Las valencias de los elementos, en su expresión más estable, pueden cambiar sus características de acuerdo con el elemento que se combinan. Por ejemplo, el grupo VII de los halógenos, su valencia principal es -1; es decir su naturaleza química lo induce a ganar un electrón. La configuración del átomo sin combinarse contiene 7 electrones en la última capa, entre los orbitales s y p; al ganar un electrón completa la tercera pareja de los orbitales p.
Aparentemente, los átomos buscan la configuración electrónica más estable a través de vías alternativas, como la pérdida o la ganancia de electrones. En el caso del grupo I es más fácil suponer que su tendencia será perder un electrón que ganar 7, necesarios para completar los orbitales s y p. Contrario a lo que sucede con los elementos del grupo VII.
Existen variaciones, sobre todo en el caso de los elementos de transición, sus valencias pueden ser muy diferentes durante las interacciones químicas. Ellos pueden originar complejos moleculares que involucran a muchos de sus electrones; sin embargo, es de esperarse debido a la amplitud de las últimas capas electrónicas de estos elementos y la escasa diferencia energética entre sus subniveles (orbitales d y f).
La respuesta correcta es la opción B.
Reactivo 5: Números de oxidación
¿Cuáles son las valencias del Cl en los compuestos HCl, HClO, \mathrm{HClO}_{2} , \mathrm{HClO}_{3} y \mathrm{HClO}_{4} respectivamente?
- \pm 1,-3,-5,-7
- \pm 1,-2,-3,-4
- \pm 1,+2,+3,+4
- \pm 1,+3,+5,+7
Solución:
La suma algebraica de los números de oxidación o valencia de cada elemento presente en el compuesto debe ser igual a cero.
\begin{array}{l} +1-1 \\ H C l \end{array} Carga neta: +1 -1 = 0
\begin{array}{l} +1+1-2 \\ H C l O \end{array} Carga neta: +1 +1 -2 = 0
\begin{array}{c} +1+3-2 \\ H C l O_{2} \end{array} Carga neta: +1 +3 – (2×2) = 0
\begin{array}{c} +1+5-2 \\ H C l O_{3} \end{array} Carga neta: +1 +5 – (2×3) = 0
\begin{array}{c} +1+7-2 \\ H C l O_{4} \end{array} Carga neta: +1 +7 – (2×4) = 0
En cada uno de los compuestos podemos ver que el Cl trabaja con las valencias, +1, -1, +3, +5 y +7 respectivamente, indicando que la respuesta correcta es la opción D.
Reactivo 6: Distribución electrónica de los elementos
Si la configuración electrónica del potasio (K) es 1 s^{2} 2 s^{2} 2 p^{6} 3 s^{2} 3 p^{6} 4 s^{1} , se localiza en la familia IA y su número atómico es 19 ¿En cuál nivel se encuentran sus electrones de valencia?
- 1
- 2
- 3
- 4
Solución:
Los electrones de valencia se encuentran en el último nivel energético, es decir su capa más externa. Para el caso del potasio, sus electrones de valencia se encuentran en el nivel 4 según la distribución electrónica 1 s^{2} 2 s^{2} 2 p^{6} 3 s^{2} 3 p^{6} 4 s^{1} .
La respuesta correcta es la opción D.
Reactivo 7: Formación de enlaces
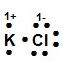
¿Cuál modelo de Lewis corresponde al compuesto iónico KCl?
Solución:
Recordemos que la estructura de Lewis es la representación electrónica de una molécula, la cual proporciona un modelo de cómo los átomos que participan en la reacción comparten electrones. En el compuesto KCl el K posee la tendencia de perder sus electrones y el Cl es un elemento que toma los electrones durante la formación de enlaces para alcanzar su estabilidad electrónica.
La estructura de Lewis para el KCl es
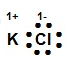
Allí se puede observar cómo el cloro se ha rodeado de ocho puntos (electrones), tomando el electrón del potasio, incrementando su carga negativa -1 y el K ha cedido su electrón quedando con carga positiva +1.
La respuesta correcta es la opción B.
Reactivo 8: Enlace químico
¿Qué tipo de enlace se presenta en el compuesto \mathrm{NH}_{3} ?
- Iónico
- Metálico
- Covalente polar
- Covalente no polar
Solución:
Un enlace covalente es el que se forma entre dos átomos que comparten un par de electrones. En moléculas idénticas como el O_{2} los elementos tienen la misma electronegatividad, por lo tanto los electrones permanecerán en el centro del espacio internuclear compartiéndose por igual.
Pero, cuando hay diferencia de electronegatividades los electrones pasarán más tiempo alrededor del elemento con mayor electronegatividad creando un enlace covalente polar, el cual es el caso del \mathrm{NH}_{3} . En donde existe una separación de cargas positivas y negativas, ya que los átomos que participan tienen diferentes electronegatividades; siendo de mayor electronegatividad el N.
La respuesta correcta es la opción C.
Reactivo 9: Enlace covalente
Seleccione las características físicas de las sustancias con enlace covalente:
- Tienen altos puntos de fusión y ebullición
- Son pobres conductores eléctricos en todas las fases
- Se pueden presentar como sólidos cristalinos
- Existen en los tres estados de agregación
- Sus puntos de fusión y ebullición son bajos
- Fundidos y en disolución acuosa conducen la corriente eléctrica
- 1, 3, 5
- 1, 4, 6
- 2, 3, 6
- 2, 4, 5
Solución:
Las características físicas de una sustancia con enlace covalente corresponde a:
- Son pobres conductores eléctricos en todas las fases, ya que sus electrones están atraídos por los núcleos de los átomos que participan en el enlace
- Existen en los tres estados de agregación (sólido, líquido y gaseoso)
- Sus puntos de ebullición y de fusión son bajos
La respuesta correcta es la opción D.
Reactivo 10: Enlace químico
¿Cuáles fuerzas se manifiestan con la atracción electrostática entre el extremo positivo de una molécula polar y el negativo de otra similar?
- London
- Maxwell
- Ion-dipolo
- Dipolo-dipolo
Solución:
Las fuerzas dipolo-dipolo son las fuerzas de atracción entre las moléculas polares o compuestos con momento dipolar. Es decir, la atracción electrostática entre un polo positivo y un polo negativo de distintas moléculas que poseen momentos dipolares.
La respuesta correcta es la opción D.
Reactivo 11: Reacciones químicas
¿Cuál es una reacción de descomposición?
- 2 M g_{(S)}+O_{2(g)} \stackrel{\Delta}{\rightarrow} 2 M g O_{(s)}
- 2 P b O_{(s)} \stackrel{\Delta}{\rightarrow} 2 P b O_{(s)}+O_{2(g)}
- 2 \mathrm{Al}_{(s)}+3 \mathrm{H}_{2} \mathrm{SO}_{4(a c)} \rightarrow 2 \mathrm{H}_{2(g)}+\mathrm{Al}\left(\mathrm{SO}_{4}\right)_{3(a c)}
- \mathrm{NaCl}_{(a c)}+\mathrm{KNO}_{3(a c)} \rightarrow \mathrm{NaNO}_{3(a c)}+K C l_{(a c)}
Solución:
Las reacciones de descomposición son aquellas en las que se rompen enlaces y se separan los elementos.
Entre las opciones del problema, la única reacción que cumple con dicho principio es
2 P b O_{(s)} \stackrel{\Delta}{\rightarrow} 2 P b O_{(s)}+O_{2(g)}
Ya que de un compuesto inicial se han generado dos elementos o dos productos.
Por lo tanto, la respuesta correcta es la opción B.
Reactivo 12: Estequiometría
Con base en la ecuación ¿Cuántos gramos de ácido sulfúrico se producen con 600 gr de trióxido de azufre? Considere las masas atómicas: H= 1, O= 16 y S= 32
\mathrm{SO}_{3(g)}+\mathrm{H}_{2} \mathrm{O}_{(l)} \rightarrow \mathrm{H}_{2} \mathrm{SO}_{4(a c)}
- 367.5
- 612.5
- 735
- 1,225
Solución:
Lo primero que debemos encontrar es el peso molecular del ácido sulfúrico y del trióxido de azufre:
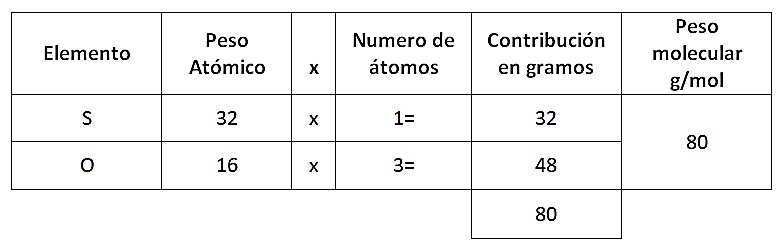
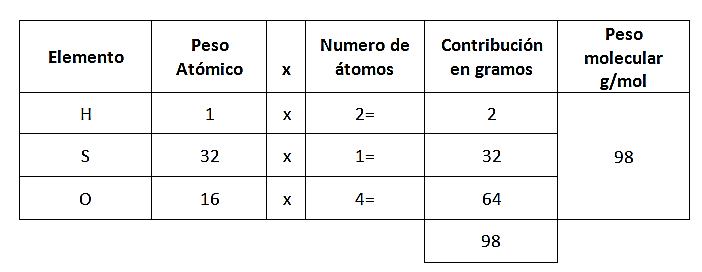
Ahora se puede establecer el siguiente análisis:
- Si con 80 g de trióxido de azufre se forman 98 g de ácido sulfúrico, con 600 g de trióxido de azufre ¿Cuántos gramos se formarán de ácido sulfúrico?
80 \mathrm{~g} \mathrm{SO}_{3} \rightarrow 98 \mathrm{gH}_{2} \mathrm{SO}_{4}
600 \mathrm{~g} \mathrm{SO}_{3} \rightarrow \mathrm{i} g \mathrm{H}_{2} \mathrm{SO}_{4} ?
Realizamos el factor de conversión:
600 \mathrm{~g} \mathrm{SO}_{3} \cdot \frac{98 \mathrm{gH}_{2} \mathrm{SO}_{4}}{80 \mathrm{~g} \mathrm{SO}_{3}}
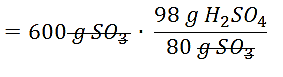
=735 \mathrm{~g} \mathrm{H}_{2} \mathrm{SO}_{4}
Con 600 g de trióxido de azufre se forman 735 g de ácido sulfúrico. La respuesta correcta es la opción C.
Reactivo 13: Conversión de unidades
Una escalera que mide 10.5 m tiene la misma longitud que una de _____ pulgadas.
- 0.026
- 34.480
- 105.00
- 413.38
Solución:
De forma indirecta, el problema está solicitando que expresemos la magnitud de una escalera de 10.5 m en pulgadas, es decir debemos realizar una conversión de unidades de metros a pulgadas. Para ello, se emplea la relación de metros a pulgadas:
1 \mathrm{~m}=39.3701 \text { pulgadas }
Decimos entonces que:
\frac{10.5 \mathrm{~m}}{1 \mathrm{~m}}=\frac{\text { Esc.en pulgadas }}{39.3701 \text { pulgadas }}
Despejamos a \text { Esc.en pulgadas } pasando a multiplicar las 39.3701 \text { pulgadas } .
\text { Esc. en pulgadas }=39.3701 \text { pulgadas } \cdot \frac{10.5 \mathrm{~m}}{1 \mathrm{~m}}
Metros se cancelan con metros y solo quedan pulgadas.
\text { Esc. en pulgadas }=413.38 \text { pulgadas }
Comparando el resultado con las opciones, marcamos como respuesta correcta a la D. Otra forma de resolver el problema, es empleando la relación inversa entre las unidades es decir, de pulgadas a metros: 1 \text { pulgada }=0.0254 \text { metros } y en lugar de multiplicar, dividimos las cantidades.
\text { Esc. en pulgadas }=\frac{10.5 \mathrm{~m}}{0.0254 \mathrm{~m}} \cdot 1 \text { pulgada }=413.38 \text { pulgadas }
Reactivo 14: Puntos cardinales
Un avión sale del aeropuerto y se dirige primero al este 1200 km y después al norte 900 km ¿Cuál es la posición de aterrizaje del avión con respecto a su salida?
- 1500 km al sur
- 1500 km al noroeste
- 2100 km al suroeste
- 2100 km al noroeste
Solución:
Tenemos diferentes alternativas para indicar la posición relativa del avión desde el aeropuerto hasta su posición de aterrizaje mediante vectores o el uso de puntos cardinales. Ya que las respuestas están dadas en puntos cardinales, será así como expresaremos nuestra solución.
Recordemos cuales son los puntos cardinales.
El problema dice que el avión primero recorre 1200 km al este y luego 900 km al norte.
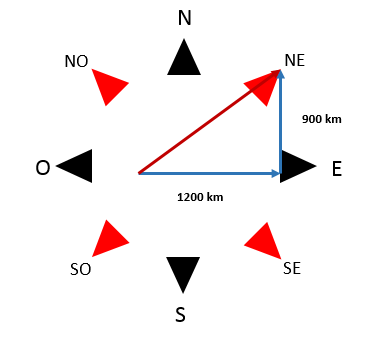
Visto sobre el diagrama cardinal, la dirección final del desplazamiento se dio hacia el noroeste. La magnitud puede determinarse aplicando el teorema de Pitágoras.
\mathrm{NE}=\sqrt{1200^{2}+900^{2}}=1500 \mathrm{~km}
Concluimos que la posición de aterrizaje es 1500 km al noroeste. Revisando las opciones, seleccionamos como correcta a la B.
Reactivo 15: Velocidad angular
Ana corre en una pista circular cuyo perímetro es de 3 km. Si corre 2 vueltas completas en 2 horas ¿Cuál es su velocidad angular?
- 0.00 rad/s
- 3 km/h
- 2 \pi km/h
- 2 \pi rad/h
Solución:
La ecuación para calcular la magnitud de la velocidad angular (o rapidez angular) es:
\omega=\frac{\Delta \theta}{\Delta t}=\frac{\theta_{2}-\theta_{1}}{t_{2}-t_{1}}[\mathrm{rad} / \mathrm{h}] \text { ó }[\mathrm{rad} / \mathrm{s}]
Dicho en palabras, la rapidez angular es igual a la variación de la posición angular \Delta \theta en un determinado intervalo de tiempo \Delta t .
En el enunciado, se indica que Ana corre dos vueltas completas, es decir que parte desde \theta_{1}=0 \mathrm{rad} y termina en \theta_{2}=4 \pi \mathrm{rad} ; en dos horas, por tanto el intervalo de tiempo es \Delta t=2 \mathrm{~h} .
Sustituimos en la ecuación:
\omega=\frac{4 \pi \mathrm{rad}-0 \mathrm{rad}}{2 \mathrm{~h}}=2 \pi \mathrm{rad} / \mathrm{h}
Comparando con las opciones del problema, la respuesta correcta es la D.
Reactivo 16: Segunda Ley del Movimiento
La aceleración que presenta un móvil se debe a:
- Que la suma de fuerzas internas es cero
- La aplicación de una fuerza interna
- La aplicación de una fuerza externa
- Que la suma de fuerzas externas es cero
Solución:
La segunda Ley de Newton del movimiento nos dice que: si la suma de fuerzas externas aplicadas a un cuerpo es distinta a cero, este experimenta una aceleración que es proporcional a la fuerza resultante en su masa.
\sum \vec{F}_{e x t}=m \vec{a}
Dicho de otra forma, un cuerpo experimenta una aceleración si se le aplica una fuerza externa distinta de cero. En base a lo anterior, escogemos como correcta a la opción C.
Reactivo 17: Principio de Arquímedes
En un recipiente graduado, que contiene 120 g de agua, se sumerge una pieza de cobre de 20 g amarrada a un hilo para que no toque el fondo. ¿Cuántos gramos se registran en la lectura del recipiente?
Considere la densidad del cobre =8.9 \mathrm{~g} / \mathrm{cm}^{3} .
- 112
- 120
- 122
- 140
Solución:
A partir del principio de Arquímedes sabemos que el volumen desplazado por un cuerpo al ser introducido en un recipiente, es igual al volumen sumergido del cuerpo.
V_{\text {des }}=V_{\text {sum }} \rightarrow V_{2}-V_{1}=V_{\text {sum }}
V_{2}=V_{1}+V_{\text {sum }}
Como la densidad del cobre es mayor a la densidad del agua, el objeto se hunde por tanto, el volumen que se desplaza es igual al volumen total de la pieza de cobre. Dicho volumen se puede determinar a partir de la densidad y masa indicadas.
\frac{m_{\text {pieza }}}{V_{\text {sum }}}=\rho_{c u} \rightarrow V_{\text {sum }}=\frac{m_{\text {pieza }}}{\rho_{c u}}
V_{\text {sum }}=\frac{m_{\text {pieza }}}{\rho_{c u}}=\frac{20 \mathrm{~g}}{8.9 \mathrm{~g} / \mathrm{cm}^{3}}=2.247 \mathrm{~cm}^{3}
Ahora, debemos equivaler esos 2.247 \mathrm{~cm}^{3} de volumen desplazado en gramos de agua, ya que la misma posee densidad de 1 \mathrm{~g} / \mathrm{cm}^{3} , al multiplicarlo por el volumen desplazado obtenemos que equivalen a 2.247 \mathrm{~g} de agua, que sumados a los 120 \mathrm{~g} obtenemos una medición en el recipiente graduado de 122.247 \mathrm{~g} .
Comparando con las opciones del problema, la respuesta correcta es la C.
Reactivo 18: Ley de los Gases Ideales
Si se tienen 0.5 L de un gas ideal confinado a 300 K de temperatura constante y a 1.5 atm de presión ¿Cómo varía el volumen, en litros, si la presión aumenta a 2 atm?
- 0.375
- 1.500
- 2.667
- 6.000
Solución:
Para sistemas con gas ideal a temperatura constante se aplica la ley de Boyle-Mariotte.
P_{1} V_{1}=P_{2} V_{2}
La presión y volumen al inicio del proceso son:
- V_{1}=0.5 \mathrm{~L}
- P_{1}=1.5 \mathrm{~atm}
La presión aumenta a 2 atm al final del proceso, el volumen V_{2} se calcula como:
V_{2}=\frac{P_{1} V_{1}}{P_{2}}=\frac{(1.5 \mathrm{~atm})(0.5 \mathrm{~L})}{2 \mathrm{~atm}}=0.375 \mathrm{~atm}
El volumen al final del proceso cambia a 0.375 \text { atm } . Comparando con las opciones, seleccionamos como correcta a la A.
Reactivo 19: Ley de Coulomb
Si la fuerza electrostática entre 2 cargas situada a una distancia r es de 10 N ¿Cuál debe ser la distancia entre las cargas para que la fuerza de atracción sea de 40 N?
- \frac{r}{4}
- \frac{r}{2}
- 2 r
- 4 r
Solución:
Como sabemos, la ley de Coulomb relaciona la fuerza de atracción o repulsión entre dos cargas eléctricas, con el cuadrado de la distancia entre ellas. La ecuación de la magnitud para dicha fuerza es:
\left|F_{q_{1} q_{2}}\right|=\frac{k_{e}\left|q_{1} q_{2}\right|}{r^{2}}
Para una distancia r_{1} la fuerza de atracción es de 10 N.
10=\frac{k_{e}\left|q_{1} q_{2}\right|}{r_{1}^{2}}
Para una distancia r_{2} la fuerza de atracción es de 40 N.
40=\frac{k_{e}\left|q_{1} q_{2}\right|}{r_{2}^{2}}
Dividimos ambas expresiones para encontrar una relación entre la distancia 1 y 2.
\frac{40}{10}=\frac{\frac{k_{e}\left|q_{1} q_{2}\right|}{r_{2}^{2}}}{\frac{k_{e}\left|q_{1} q_{2}\right|}{r_{1}^{2}}}
Simplificamos.
4=\frac{r_{1}^{2}}{r_{2}^{2}}
Despejamos a r_{2} .
r_{2}^{2}=\frac{r_{1}^{2}}{4} \rightarrow r_{2}=\frac{r_{1}}{2}
Para que la fuerza sea 40 N, la distancia 2 debe recortarse a la mitad de la distancia 1.
Comparando con las opciones, seleccionamos como respuesta correcta a la B.
Reactivo 20: Conductividad eléctrica
En general, los metales son buenos conductores de la electricidad por…
- Sus propiedades físicas
- Ser resistentes al calor
- Ser sensibles a los campos magnéticos
- Tener pocos electrones en la última órbita de sus átomos
Solución:
Los metales poseen distintas características y entre ellas, destaca su gran facilidad para la conducción térmica y eléctrica. Esto se debe a que los electrones en la última capa de valencia están ligados de forma débil al átomo, formando lo que se conoce como gas electrónico.
La teoría del Gas Electrónico, es un modelo cualitativo que permite explicar las características de conducción de los metales. Dicho “gas” le confiere a los electrones la capacidad de desplazarse con facilidad con la presencia de un campo eléctrico.
En base a nuestro análisis, seleccionamos como respuesta correcta a la opción D.
Reactivo 21: Ley de Inducción de Faraday
¿Cuál es la fuerza electromotriz (FEM), en volts, inducida en una espira de alambre cuando al acercar un imán, el flujo magnético cambia de \Phi_{1}=1.2 \times 10^{-2} \mathrm{~Wb} a \Phi_{2}=4.6 \times 10^{-2} \mathrm{~Wb} en un intervalo de 1.7 \times 10^{-2} segundos?
- 0.0324
- 0.1534
- 2.00
- 3.41
Solución:
La ley de Faraday establece que la variación en el tiempo del flujo magnético que atraviesa una espira cerrada es proporcional a la Fuerza Electromotriz FEM que se induce en los terminales de la espira.
\mathrm{FEM} \propto n \frac{d \Phi(t)}{d t}
Donde n es el número de espiras. En el problema se indica que la espira tiene una sola vuelta y conocemos solo la intensidad del flujo magnético al inicio y al final, junto al intervalo de tiempo en el que ocurre. Por esta razón, expresamos a la FEM como:
\mathrm{FEM}=\frac{\Delta \Phi}{\Delta t}=\frac{\Phi_{2}-\Phi_{1}}{\Delta t}
Sustituimos.
\mathrm{FEM}=\frac{\left(4.6 \times 10^{-2} \mathrm{~Wb}\right)-\left(1.2 \times 10^{-2} \mathrm{~Wb}\right)}{1.7 \times 10^{-2} \mathrm{~s}}=\frac{3.4 \times 10^{-2} \mathrm{~Wb}}{1.7 \times 10^{-2} \mathrm{~s}}=2 \frac{\mathrm{Wb}}{\mathrm{s}}=2 \mathrm{Volts}
Comparando con las opciones del problema, la respuesta correcta es la C. Debemos aclarar que esta no es la ley de inducción definitiva. Faraday en un principio, no pudo explicar porque la FEM era negativa y fue Lenz quien explicó rigurosamente la razón. Motivo por el que se le llamó:
Ley de Inducción de Faraday-Lenz.
\mathrm{FEM}=-n \frac{d \Phi(t)}{d t}
Reactivo 22: Óptica
¿Cuál propiedad de la luz se presenta cuando al meter un lápiz dentro de un vaso con agua este parece como si estuviera quebrado?
- Reflexión
- Dispersión
- Difracción
- Refracción
Solución:
El fenómeno que se describe en el enunciado del problema, se denomina refracción de la luz. Ocurre cuando la luz experimenta un cambio del medio en el que se propaga, esto se traduce en una disminución de la velocidad de propagación y en un cambio de dirección.
El principio de Fermat para el movimiento de la luz entre diferentes medios, indica que la misma sigue la trayectoria óptica con menor recorrido, por esta razón al cambiar de medio el lápiz parece estar quebrado dentro del agua.
Concluimos entonces que la respuesta correcta es la opción D.