En este examen simulador para a resolver 75 ejercicios de química con temas de la guía del IPN para carreras del área de ciencias médico biológicas.

En esta primera parte vamos a comenzar con los primeros 15, recuerda que lo más importante es que practiques con ejercicios similares a los de tu examen. Accede a la segunda parte en el siguiente botón.
Estructura del Examen IPN
Según las estadísticas anuales, el 80% de los aspirantes resulta rechazado en el IPN.
En pocas palabras, si vas a aplicar a alguna carrera de la salud (suelen ser las más difíciles) debes prepararte estudiante los temas y sobre todo poniendo a prueba tus conocimientos.
El examen de ingreso al Politécnico Nacional consta de dos grandes módulos: conocimientos generales y conocimientos experimentales.
Las carreras del IPN se agrupan en tres grandes ramas del conocimiento, las cuales determinaran el temario y estructura del examen que vas a presentar:
- IyCFM: Ingeniería y ciencias físico matemáticas
- CMD: Ciencias médico biológicas
- CSyA: Ciencias sociales y administrativas
La dificultad de los módulos no es igual para todas las carreras. En el área de CMB las unidades más complejas son química y biología, por lo que debes prestar atención especial a toda la información que te brinda el simulacro.
Carreras IPN CMB
Si tienes dudas de si tu carrera pertenece a esta área, aquí tienes la lista completa de los programas académicos del área de ciencias médico biológicas:
- Licenciatura en Biología
- Licenciatura en Enfermería
- Licenciatura en Enfermería y Obstetricia
- Licenciatura en Nutrición
- Licenciatura en Odontología
- Licenciatura en Optometría
- Licenciatura en Psicología
- Licenciatura en Trabajo Social
- Médico Cirujano Homeópata
- Médico Cirujano Partero
- Químico Farmacéutico Industrial
- Químico Bacteriólogo y Parasitólogo
En la siguiente tabla resumen puedes conocer la cantidad de reactivos para tu examen de admisión según el área de tu carrera:
| Materia | IyCFM | CMB | CSyA |
|---|---|---|---|
| Matemáticas | 37 | 33 | 35 |
| Competencia escrita | 20 | 20 | 25 |
| Competencia lectora | 20 | 20 | 20 |
| Reading comprehension | 10 | 10 | 10 |
| Historia | 10 | 10 | 20 |
| Biología | 9 | 17 | 10 |
| Química | 17 | 17 | 10 |
| Física | 17 | 13 | 10 |
Temario de Química CMB
- Química I
- Materia
- Estructura atómica
- Tabla periódica
- Enlace químico
- Nomenclatura química orgánica
- Reacciones químicas orgánicas
- Química II
- Balanceo de ecuaciones químicas
- Estequiometría
- Estructura de compuestos orgánicos
- Nomenclatura y aplicación (Reglas de nomenclatura IUPAC para compuestos orgánicos)
- Química III
- Reacciones químicas de compuestos orgánicos
- Estado gaseoso
- Disoluciones
- Electroquímica
- Química IV
- Termoquímica
- Velocidad de reacción y equilibrio químico
- Ácidos y bases
- Tecnología química
¿Cómo resolver el simulacro?
Estos problemas han sido diseñados para que puedas practicar los temas del examen real y mejorar el tiempo que tardas en resolverlos.
Las siguientes son sugerencias para tener en cuenta mientras estudias con este simulacro.
- Antes de consultar la respuesta, intenta resolverlo por tu cuenta.
- Mide tu tiempo e imagínate que estás presentando el examen real.
- Compara tus resultados con la respuesta correcta.
- No te detengas con ejercicios que se te hacen muy complejos, regresa a ellos, ya que respondas los que dominas.
En el examen te vas a encontrar problemas que plantean situaciones reales, y aquellos que se pueden resolver únicamente con un procedimiento.
Reactivo 1
La ___________ se utiliza para separar partículas sólidas muy pequeñas suspendidas en un líquido.
- Decantación.
- Centrifugación.
- Imantación.
- Condensación.
Solución:
La centrifugación es un método de separación de mezclas encargado de separar partículas sólidas muy pequeñas suspendidas en un líquido. Se lleva a cabo con el uso de una máquina centrífuga que gira a gran velocidad (RPM). El eje de rotación de la centrífuga, deposita los elementos densos en el fondo del tubo de ensayo mientras que el de menor densidad se mantiene en la superficie.
Es un método de separación indispensable en el laboratorio clínico, ya que permite el análisis de muestras sanguíneas separando los elementos formes de la sangre del suero o plasma
Respuesta correcta opción B.
Reactivo 2
Establezca la relación entre el tipo de moléculas y la sustancia química:

- 1ACB, 2DE
- 1BCD, 2AE
- 1ABD, 2CE
- 1CE, 2ABD
Solución:
Las moléculas diatómicas contienen únicamente dos átomos en su estructura a diferencia de las moléculas poliatómicas que están formadas por la unión de dos átomos. En este sentido podemos relacionar:
- Moléculas diatómicas: {H}_{2} , {O}_{2} y C{l}_{2} (relación 1ABD).
- Moléculas poliatómicas: C{H}_{4} y {H}_{2}S{O}_{4} (relación 2CE).
Respuesta correcta opción C.
Reactivo 3
Seleccione las opciones que representen elementos químicos
- Wolframio
- Amonio
- Rubidio
- Gas natural
- 1, 3
- 2, 4
- 1, 4
- 2, 3
Solución:
Los elementos químicos son:
- Tungsteno o wolframio (W) perteneciente al grupo 6 de la tabla periódica.
- Rubidio (Rb) es un metal alcalino, perteneciente al grupo 1 de la tabla periódica.
Respuesta correcta opción A.
Reactivo 4
¿Qué tipo de enlace posee la molécula de agua?
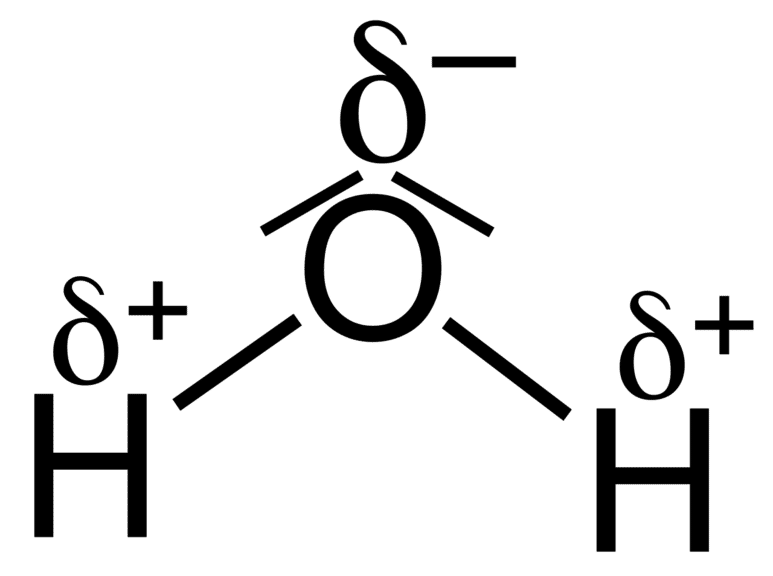
- Iónico
- Covalente
- Puente de hidrógeno
- Interacción electrostática
Solución:
Los átomos de la molécula de agua están unidos mediante enlaces covalentes, de forma más específica, se relacionan a través de enlaces covalentes polares.
El enlace covalente polar sucede cuando el compartimiento y comportamiento de los electrones se ve afectado por una diferencia de electronegatividades entre los compuestos de la molécula.
Como la molécula de agua posee un átomo más electronegativo, como lo es el oxígeno, los electrones se acercarán al elemento con mayor fuerza de atracción por los electrones, generando una zona de densidad negativa δ- (sobre él mismo) y una zona de densidad positiva δ+ (sobre los elementos de menor electronegatividad).
Es decir, que los electrones pasaran más tiempo alrededor del elemento de mayor electronegatividad, que en el caso del agua es el oxígeno.
Respuesta correcta opción B.
Reactivo 5
En la siguiente reacción química, indique cual es el elemento que se reduce:
Zn+2HCl \to ZnC{l}_{2}+{H}_{2}
- Zn
- Zn y Cl
- H
- H y Cl
Solución:
Para conocer el elemento que se reduce debemos asignarle los números de oxidación a cada elemento que participa en la reacción del lado de los reactantes y productos:
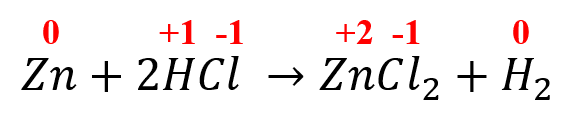
Es importante recordar que la teoría nos dice, cualquier elemento que se encuentre sin combinar en la reacción tendrá al cero como número de oxidación.
El hidrógeno es el elemento que se reduce, ya que gana electrones. De tener un valor positivo del lado de los reactantes, gana electrones y disminuye su número de oxidación.
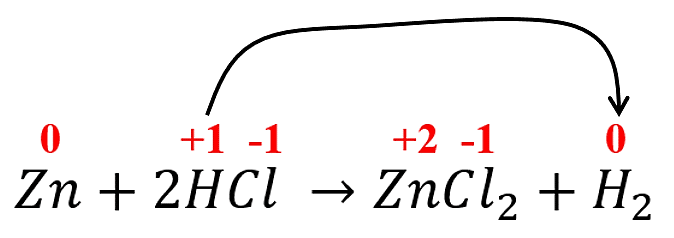
Respuesta correcta opción C.
Reactivo 6
La ley de conservación de materia, también llamada ley de conservación de la masa, se cumple cuando:
- La masa total de los reactantes es igual a la masa total de los productos.
- La masa total de los reactantes difiere de la masa de los productos gaseosos.
- La masa total de los reactantes es inferior a la masa total de los productos y se conserva la energía.
- La masa total de los reactantes es superior a la masa total de los productos y se conserva la energía.
Solución:
La materia está formada por átomos, los cuales no cambian su composición durante una reacción química, solo se reordenan. Por ello, la ley de conservación de la masa expresa que la materia no se crea ni se destruye, solo se transforma. Una forma de evidenciarlo a través de la masa total de los reactantes y productos, el valor final es igual a ambos lados de la reacción.
Para cálculos estequiométricos, el balanceo de una ecuación química consiste en igualar el número de átomos de los reaccionantes con el número de átomos de las sustancias producidas. Lo que constituye otra de las aplicaciones de la ley de la conservación de la masa, ya que durante la reacción no se producirán o destruirán nuevos átomos, la cantidad debe ser igual a ambos lados porque solo serán reordenados.
Respuesta correcta opción A.
Reactivo 7
Seleccionar el proceso químico en el que un elemento gana electrones cuando ocurre la reacción química:
- Reducción
- Oxidación
- Desplazamiento
- Eliminación
Solución:
Cuando ocurre una transferencia de electrones en las reacciones químicas, los elementos que participan pueden ganar o perder cargas negativas y en su defecto se oxidan o se reducen.
Durante un proceso químico, un elemento que gana electrones se reduce. En el ejercicio se puede visualizar gracias a los cambios del número de oxidación de los elementos antes y después de la reacción.
Respuesta correcta opción A.
Reactivo 8
Calcular el porcentaje de K presente en el compuesto KCl. Masas atómicas (g/mol): K= 39; Cl = 35.5
- 50 %
- 52.3 %
- 47.7 %
- 57.1 %
Solución:
Para conocer la composición porcentual de un elemento se necesita el peso molecular de la sustancia.
Número de átomos por masa atómica
- K: 39 g/mol\times 1=39 g/mol
- Cl: 35.5 g/mol \times 1=35.5 g/mol
PM del KCl=\left(35.5+39\right) g/mol=74.5 g/mol
PM del {H}_{2}S{O}_{4}=74.5 g/mol
El porcentaje de potasio se encuentra al dividir la masa del elemento entre la masa del compuesto y el resultado se multiplica por 100:
\%K:\frac{39 g K}{74.5 g KCl}\times 100=52.3 \%
El porcentaje de potasio presente en la sal cloruro de potasio es de 52.3 % del total. La respuesta correcta es la opción B.
Reactivo 9
¿Cuál es el tipo de hibridación que presenta el tripe enlace entre carbono y carbono de los hidrocarburos?
- sp
- s{p}^{2}
- s{p}^{3}
- s{p}^{2} y s{p}^{3}
Solución:
El triple enlace C\equiv C se forman cuando el carbono comparte seis electrones y presenta el tipo de hibridación sp. Es un tipo de enlace que se encuentra en los alquinos. Están orientados 180° en el eje de las x, por lo que tienen una configuración lineal.
Respuesta correcta opción A.
Reactivo 10
Identificar el nombre del derivado monosustituido del benceno
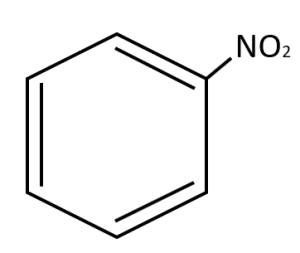
- Ácido benzoico
- Tolueno
- p-tolueno
- Nitrobenceno
Solución:
En el compuesto, el nombre principal es el del benceno y el grupo nitro se nombra al inicio, por lo tanto, la nomenclatura correcta es: nitrobenceno.
El nitrobenceno es un compuesto derivado de los hidrocarburos, no se encuentra de forma natural en el medio ambiente y se utiliza en procesos químicos como disolvente, entre otras funciones.
Respuesta correcta opción D.
Reactivo 11
La presión total de una mezcla de gases es igual a la suma de las presiones que cada gas tendría si estuviera solo. El enunciado corresponde a:
- Ley de Charles
- Ley de Dalton de las presiones parciales.
- Ley de Gay-Lussac
- La comprensibilidad de los gases.
Solución:
Cuando la presión ejercida por un tipo de molécula no es afectada por la presencia de otro gas, la presión total de la sustancia es el resultado de la suma de las presiones individuales de cada gas cuando las moléculas no se atraen o repelen entre sí.
En otras palabras, La presión total de una mezcla de gases es igual a la suma de las presiones que cada gas tendría si estuviera solo, lo que corresponde con la ley de Dalton de las presiones parciales.
Respuesta correcta opción B.
Reactivo 12
Identificar que disolución representa la siguiente expresión:
\%Volumen=\frac{Volume{n}_{soluto}}{Volume{n}_{solución}} \times 100
- Concentración porcentual
- Concentración cualitativa
- Concentración molar
- Concentración ppm
Solución:
La expresión que expone el enunciado nos habla de la concentración porcentual volumen/volumen. Expresa el volumen de soluto contenido en 100 ml de una solución.
Respuesta correcta opción A.
Reactivo 13
Cuando se busca aumentar la concentración de una disolución, la operación a seguir consiste en agregar una mayor cantidad de ___________ a la mezcla.
- Agua
- Solvente
- Soluto
- Disolvente
Solución:
Cuando se busca aumentar la concentración de una disolución, la operación a seguir consiste en agregar una mayor cantidad de soluto a la mezcla.
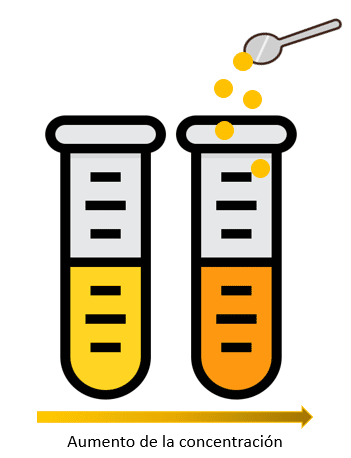
Respuesta correcta opción C.
Reactivo 14
Durante una corrida electroforética los átomos o moléculas de carga positiva migran hacia el:
- Ánodo
- Cátodo
- Gel
- Polo positivo
Solución:
En la electroforesis el polo negativo es el cátodo, lleva ese nombre porque es hacia donde migran las moléculas de carga positiva, aunque su carga es negativa
Respuesta correcta opción B.
Reactivo 15
En una celda galvánica, el puente salino es una solución de sal que puede ser:
- Óxido de zinc
- Hidruro de litio
- Óxido de potasio
- Cloruro de potasio
Solución:
En las celdas galvánicas se necesita un puente salino, un tubo que contiene una disolución hecha de algún electrolito inerte como el KCl, cuyos iones no reaccionan con los electrodos y los cationes o aniones que viajan a través de él de una semicelda a la otra, completando el circuito.
Respuesta correcta opción D.

