¿Has estado concentrado en tu preparación para el Exani II? De ser así, estás bienvenido a continuar con esta tercera parte de nuestra guía de reactivos resueltos en Química. También, puedes ver las otras partes de esta guía con los enlaces que te hemos dejado justo acá abajo. ¡Continúa leyendo y no dejes de prepararte!

Conoce algunos detalles importantes del Exani II acá:
- Desarrollo: Ceneval
- Examen de admisión: Exani II
- Reactivos: 168
- Tipo: Opción múltiple
- Duración: 4 horas y media
- Modalidades: Presencial, en línea y desde casa.
Estructura del Exani II
Antes de iniciar a resolver los ejercicios de esta guía de Química, creemos que es clave que tengas bien claro cuáles la forma y composición del Exani II.
Por tal motivo, a continuación te desglosamos los detalles referentes al mismo, así que presta atención:
| Área | Reactivos |
|---|---|
| Habilidades y conocimientos | |
| Pensamiento matemático | 30 |
| Comprensión lectora | 30 |
| Redacción indirecta | 30 |
| Módulos de conocimientos específicos | |
| Módulo 1 | 24 |
| Módulo 2 | 24 |
| Subtotal de reactivos | 138 |
| Diagnóstico | |
| Inglés | 30 |
| Total de reactivos | 168 |
Tabla Estructura Exani II
En vista de que en el 2021 fue modificada la estructura del Exani, es necesario que comprendas que algunas áreas de conocimiento presentes en la versión anterior ya no están presentes en la nueva. Asimismo, existen nuevos módulos de conocimiento específicos que están presentes en el Exani II.
En vista de ello, acá puedes ver a detalle, todos los cambios y detalles referentes al Exani II de Ceneval:
Ejercicio 21: Reacciones químicas
¿Cuál es una reacción de descomposición?
- 2 M g_{(S)}+O_{2(g)} \Delta \rightarrow 2 M g O_{(s)}
- 2 \mathrm{PbO}_{(s)} \Delta \rightarrow 2 \mathrm{PbO}_{(s)}+\mathrm{O}_{2(g)}
- 2 \mathrm{Al}_{(s)}+3 \mathrm{H}_{2} \mathrm{SO}_{4(a c)} \rightarrow 2 \mathrm{H}_{2(g)}+\mathrm{Al}\left(\mathrm{SO}_{4}\right)_{3(a c)}
- \mathrm{NaCl}_{(a c)}+\mathrm{KNO}_{3(a c)} \rightarrow \mathrm{NaNO}_{3(a c)}+K C l_{(a c)}
Solución:
Las reacciones de descomposición son aquellas en las que se rompen enlaces y se separan los elementos.
Entre las opciones del problema, la única reacción que cumple con dicho principio es
2 \mathrm{PbO}_{(s)} \Delta \rightarrow 2 \mathrm{PbO}_{(s)}+\mathrm{O}_{2(g)}
Ya que de un compuesto inicial se han generado dos elementos o dos productos.
Por lo tanto, la respuesta correcta es la opción B.
Ejercicio 22: Estequiometría
Con base en la ecuación ¿Cuántos gramos de ácido sulfúrico se producen con 600 gr de trióxido de azufre? Considere las masas atómicas: H= 1, O= 16 y S= 32
\mathrm{SO}_{3(g)}+\mathrm{H}_{2} \mathrm{O}_{(l)} \rightarrow \mathrm{H}_{2} \mathrm{SO}_{4(a c)}
- 367.5
- 612.5
- 735
- 1,225
Solución:
Lo primero que debemos encontrar es el peso molecular del ácido sulfúrico y del trióxido de azufre:
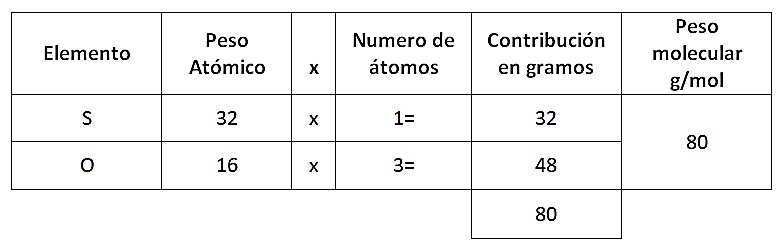
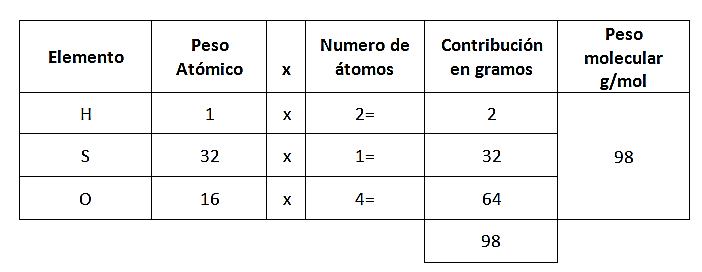
Ahora se puede establecer el siguiente análisis:
- Si con 80 g de trióxido de azufre se forman 98 g de ácido sulfúrico, con 600 g de trióxido de azufre ¿Cuántos gramos se formarán de ácido sulfúrico?
80 \mathrm{~g} \mathrm{SO}_{3} \rightarrow 98 \mathrm{~g} \mathrm{H}_{2} \mathrm{SO}_{4}
600 \mathrm{~g} \mathrm{SO}_{3} \rightarrow ¿ g \mathrm{H}_{2} \mathrm{SO}_{4} ?
Realizamos el factor de conversión:
600 \mathrm{~g} \mathrm{SO}_{3} \cdot \frac{98 \mathrm{~g} \mathrm{H}_{2} \mathrm{SO}_{4}}{80 \mathrm{~g} \mathrm{SO}_{3}}
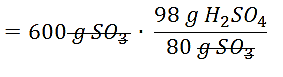
=735 \mathrm{~g} \mathrm{H}_{2} \mathrm{SO}_{4}
Con 600 g de trióxido de azufre se forman 735 g de ácido sulfúrico. La respuesta correcta es la opción C.
Ejercicio 23: Soluciones
La ___________ expresa la cantidad de soluto que un solvente puede contener y es considerada una propiedad característica de cada uno de los materiales conocidos.
- Solución
- Solubilidad
- Polaridad
- Temperatura
Solución:
La solubilidad es un término utilizado para definir la capacidad máxima de soluto que un solvente puede contener para que se forme una solución. Si se agrega un exceso de soluto éste no formará parte de la solución.
El grado de facilidad con la cual un soluto se dispersa en un solvente será proporcional a la interacción que se produzca entre ellos. La solubilidad de una sustancia en otra depende de la similitud entre cargas, presión y temperatura.
En base a la teoría, la respuesta correcta es la opción B.
Ejercicio 24: Compuestos químicos
El _______ es una base que se usa para la fabricación de jabones y colorantes, es soluble en agua y reacciona con el HCL para formar NaCl.
- \mathrm{H}_{2} \mathrm{SO}_{4}
- \mathrm{Li}_{2} \mathrm{O}
- CO
- NaOH
Solución:
Los hidróxidos se caracterizan por tener un sabor amargo, ser jabonosos al tacto y muy corrosivos, es por ello que su manipulación debe ser estrictamente controlada. Son buenos conductores de electricidad en disoluciones acuosas y participan en dos reacciones importantes:
- Reaccionan con ácidos para formar sal y agua (reacción de neutralización)
- Reaccionan con los óxidos no metálicos para formar sal y agua
Las bases se reconocen porque son compuestos que poseen el grupo hidroxilo (-OH) en su estructura. Al evaluar las opciones que nos brinda el enunciado, el NaOH es el compuesto que corresponde a una base.
El hidróxido de sodio (NaOH), en efecto, es una base que se utiliza en la fabricación de jabones y colorantes; además se emplea para la obtención de celulosa de madera. El NaOH, también llamado soda cáustica, es un compuesto que se emplea en los jabones poco refinados en gran proporción y tiende a dañar los tejidos, es corrosivo y cuando se combina con HCl produce NaCl.
\mathrm{NaOH}+\mathrm{HCl} \rightarrow \mathrm{NaCl}+\mathrm{H}_{2} \mathrm{O}
Fundamentándonos en la teoría y con la reacción de neutralización en la que participa el NaOH podemos confirmar que la respuesta correcta es la opción D.
Ejercicio 25: Estados de agregación de la materia
¿Cuál es el estado más rígido de la materia porque sus partículas se encuentran más cercanas unas de otras?
- Coloide
- Gaseoso
- Sólido
- Líquido
Solución:
El estado sólido es el estado más rígido de la materia porque sus moléculas se encuentran muy cerca unas de otras, de forma compacta, poseen una nula capacidad de movimiento y la estructura que adoptan requiere un bajo contenido de energía térmica. A diferencia del estado gaseoso, en el cual las partículas tienen un alto rango de movimiento y es el estado de agregación de la materia más desordenado.
La respuesta correcta es la opción C.
Ejercicio 26: Enlace químico
Identifica las moléculas poliatómicas:
- P_{4}
- O_{2}
- \mathrm{HCl}
- \mathrm{CO}_{2}
- \mathrm{H}_{2} \mathrm{SO}_{4}
- 1, 2, 3
- 2, 3, 5
- 1, 4, 5
- 5, 2, 3
Solución:
Una molécula es una partícula formada por un número definido de átomos iguales o diferentes. Es la muestra representativa más pequeña de un compuesto que puede existir en forma estable e independiente. Existen, por lo general, en forma: monoatómicas, diatómicas y poliatómicas.
- Las moléculas monoatómicas son aquellas que existen de manera estable como átomos aislados. Este es el caso particular de los gases nobles como el helio, argón, kriptón, entre otros
- Las moléculas diatómicas están formadas por dos átomos iguales o diferentes. En las opciones del enunciado podemos observar que el \mathrm{O}_{2} y el HCl son un ejemplo de moléculas diatómicas
- Las moléculas poliatómicas están formadas por más de dos átomos iguales o diferentes. Corresponde los compuestos: \mathrm{P}_{4}, \mathrm{CO}_{2} \text{ y } \mathrm{H}_{2} \mathrm{SO}_{4} encontrados en las opciones del enunciado
En base a ello, las moléculas poliatómicas se hallan en la posición 1, 4, 5 siendo respuesta correcta la opción C.
Ejercicio 27: Compuestos químicos
Relacione los siguientes óxidos metálicos con su fórmula química correspondiente:
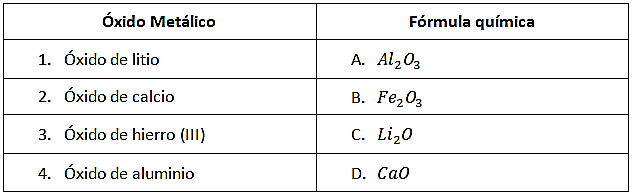
- 1A, 2D, 3B, 4C
- 1D, 2A, 3C, 4B
- 1A, 2B, 3C, 4D
- 1C, 2D, 3B, 4A
Solución:
Los óxidos metálicos son compuestos que se forman al reaccionar el oxígeno con el metal. Para relacionar la fórmula química de cada compuesto se debe identificar los elementos que participan en la reacción.
- El óxido de litio es la combinación de litio más oxígeno, la fórmula química debe tener (Li), se corresponde con \mathrm{Li}_{2} \mathrm{O} y la relación es 1C
- El óxido de calcio se corresponde con su fórmula CaO y la relación es 2D
- Óxido de hierro (III) el (III) significa que el hierro trabaja con su valencia +3, la fórmula química será \mathrm{Fe}_{2} \mathrm{O}_{3} (recuerda que se intercambian las valencias en la formación de compuestos) La relación es 3B
- El óxido de aluminio corresponde a la fórmula \mathrm{Al}_{2} \mathrm{O}_{3} la relación es 4A
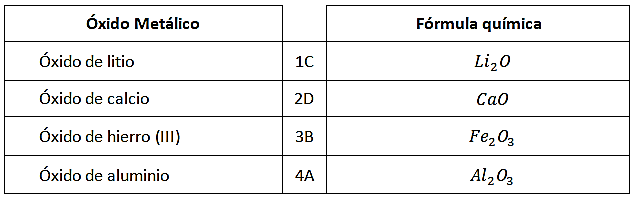
La respuesta correcta es la opción D.
Ejercicio 28: Energía calórica
La _______ es una medida del grado de orden o desorden de las partículas que constituyen una sustancia.
- Entropía
- Entalpía
- Entalpía de disociación
- Energía
Solución:
La espontaneidad de un proceso químico se relaciona con el reordenamiento de los átomos y moléculas, desde una situación menos probable hasta una más probable, esto es lo que se conoce como entropía.
De modo conceptual, se explica que la entropía es una medida del grado de orden o desorden de las partículas que constituyen una sustancia. En cualquier sustancia la entropía aumenta en la medida que disminuye la presión, aumenta la temperatura y la masa (propiedad extensiva), y disminuye con las restricciones en los movimientos de las partículas.
Por lo tanto la respuesta correcta es la opción A.
Ejercicio 29: Unidades de concentración
¿Qué volumen de solución se puede preparar con 0.30 moles de un soluto si se desea una concentración de 0.1 molar?
- 0.03 L
- 0.3 mol/L
- 0.3 L
- 3 L
Solución:
La unidad de concentración que se trata en el enunciado es la molaridad, por lo tanto debemos recordar que su fórmula es:
M=\frac{N^{\circ} \text { de moles }}{V \text { solución }(L)}
En el problema nos están proporcionando la siguiente información:
- N° de moles, el cual es 0.30 moles
- Molaridad (M) concentración, 0.1 M
Y lo que se desea conocer es el volumen de la solución en litros.
Para conocer el V de la solución debemos despejar V de la fórmula:
V \text { solución }=\frac{N^{\circ} \text { de moles }}{M}
Sustituimos los valores:
V \text { solución }=\frac{0.30 \text { moles }}{0.1 \mathrm{~mol} / \mathrm{L}}
V \text { solución }=3 L
Con 0.30 moles de soluto y un volumen de 3 L se puede preparar una solución con 0.1 M de concentración. La respuesta correcta es la opción D.
Ejercicio 30: Soluciones
¿Cuál es el proceso utilizado frecuentemente en los laboratorios, industrias, diversos ambientes y hogar en el cual se disminuye la concentración de una solución agregando diversos volúmenes de solvente?
- Mezcla
- Centrifugación
- Dilución
- Evaporación
Solución:
La dilución es el proceso de preparación de una solución de menor concentración a partir de otra de mayor concentración, agregando solvente.
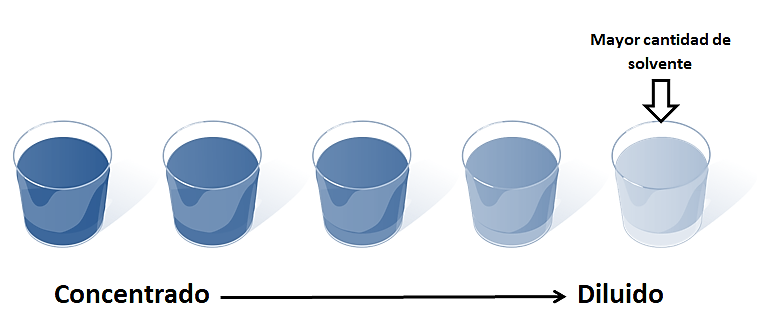
Cuando se toma una porción de una solución original (madre) de cierta concentración, se separa una pequeña cantidad de soluto del resto que se encuentra disuelto, al añadir solvente se le proporciona un espacio mayor para su dispersión. Esto se traduce en una disminución de la cantidad de soluto por unidad de volumen presente en una solución denominada “hija” (de menor concentración).
En base a la teoría la respuesta correcta es la opción C.

