¿Quieres saber que es el átomo del carbono? Los conocimientos de la química orgánica se basan en el estudio del carbono. La compresión de uno de los átomos más importantes de la química es esencial para desempeñar habilidades dentro de la medicina, odontología, nutrición, biotecnología, ingeniería y más.

Analiza cada cualidad del carbono con nosotros y descubre que es el componente principal de la materia viva, pero también de otras sustancias necesarias para el desarrollo farmacéutico e industrial.
¿Qué es el carbono?
También se halla en el aire como dióxido de carbono. De forma elemental podemos encontrar el carbono como diamante, fullereno y grafito (formas alotrópicas). Las cuales son sustancias con propiedades inorgánicas comunes.
El carbono posee propiedades que le otorgan cualidades extraordinarias para la formación de millones de compuestos. La rama de la química que se dedica al estudio del carbono se llama química orgánica.
Características del átomo de carbono
- Símbolo en la tabla periódica: C
- Pertenece al grupo IV A de la tabla periódica.
- Masa atómica: 12.011
- Número atómico: 6
Propiedades del carbono
- Capacidad para formar largas cadenas carbonadas estableciendo enlaces covalentes entres sus átomos.
- El carbono es el único elemento que sufre los tres tipos de hibridación que hay: sp, sp2 y sp3 originando así, compuestos que presentan enlaces covalentes sencillos, dobles y triples.
- Posee 4 electrones en su último nivel de energía, los cuales son responsables de los múltiples enlaces que puede formar.
- Por lo general se encuentra en estado sólido a temperatura ambiente.
- Adopta diferentes conformaciones alotrópicas.
- Es el principal constituyente de la materia viva.
Estructura del átomo de carbono
La mayor cantidad de masa se concentra en el núcleo, pero son los electrones quienes participan en la formación de enlaces durante las reacciones químicas.
Sin embargo, las propiedades químicas de cualquier elemento se establecen mediante el número de protones contenidos en el núcleo y el análogo número de electrones alrededor de éste.
En conclusión, conocer la cantidad de protones y la masa atómica de un elemento se vuelve indispensable para saber la interacción química que tendrá durante las reacciones que se dan bajo diferentes condiciones.
El carbono tiene:
- Número atómico (Z) igual a 6 es decir posee 6 protones en su núcleo.
- Tiene 6 electrones, en estado neutro, de los cuales, cuatro electrones están en su último nivel de energía (electrones de valencia).
- La masa atómica (A) es igual a 12, en el carbono común, pero la cantidad de neutrones puede variar para dar origen a los isótopos del carbono.
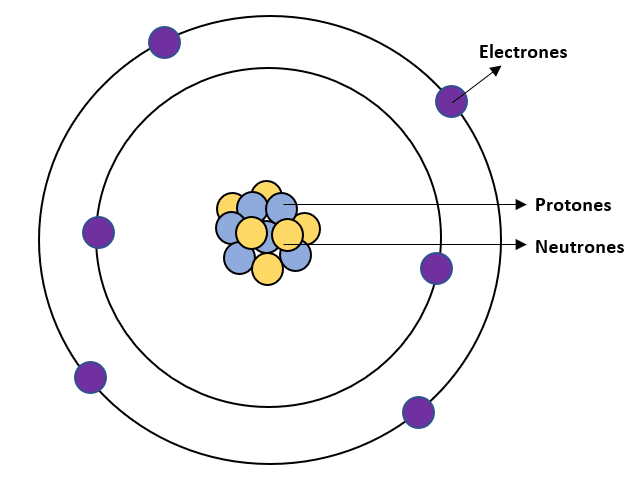
Representación esquemática de la estructura del átomo de carbono
¿Cuáles son los isótopos del carbono?
El número de masa (la suma de protones y neutrones) de un átomo puede variar debido al cambio en la cantidad de neutrones, como se mencionó con anterioridad, por ello se originan los siguientes isótopos del carbono:
- 13C: El carbono 13 posee 7 neutrones y 6 protones en el núcleo, por lo tanto, A = 13. Tiene una amplia utilidad para detectar infecciones estomacales por Helicobacter pylori, a través de la prueba de aliento. También se utiliza en la espectrometría de masa para determinar la composición de una muestra problema.
- 14C: El carbono 14 es un isótopo radiactivo con una vida promedio de 5730 años. Tiene 6 protones y 8 neutrones en el núcleo, por lo tanto, A = 14. El decaimiento predecible de los ácidos nucleicos del carbono 14 se utiliza para establecer la antigüedad de la materia orgánica de hasta 50,000 años atrás.
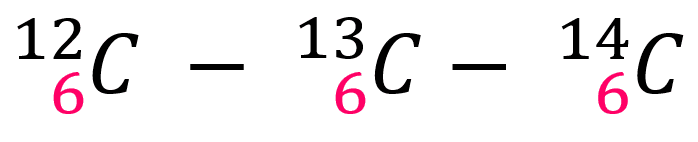
Los isótopos del carbono poseen una misma cantidad de protones, pero difieren en la cantidad de neutrones y por ende su masa atómica cambia, como lo muestra la imagen.
Estructura electrónica de los átomos
Según el principio de incertidumbre de Heisenberg nunca podremos determinar la posición exacta de un electrón.
Aun así, se puede conocer la densidad electrónica, es decir, la probabilidad de encontrar al electrón en un sitio puntual del orbital.
En otras palabras, un orbital se conoce como el estado de energía de un electrón con una distribución de densidad electrónica en el espacio, el cual es producto de la probabilidad.
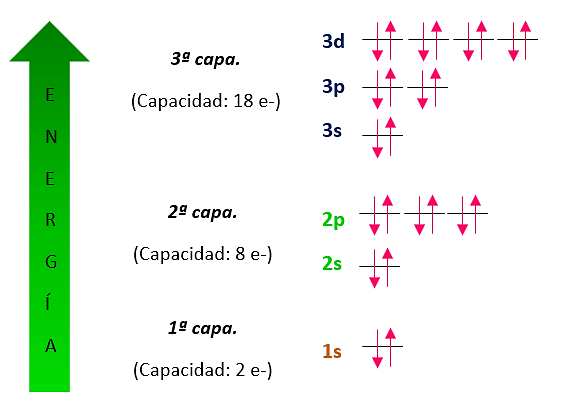
Los orbitales atómicos se ubican en capas sucesivas a diferentes distancias del núcleo. Pero, ¿Cuáles son los orbitales? Existen cuatro tipos de orbitales diferentes representados por las letras s, p, d y f. Cada uno de ellos solo puede contener dos electrones.
- La primera capa es un único orbital s se identifica como 1s y posee dos electrones
- La capa N°2 contiene un orbital 2s y tres orbitales 2p para albergar un total de 8 electrones. Los tres orbitales p están orientados en el espacio a lo largo de direcciones perpendiculares entre sí, representadas por {p}_{x}, {p}_{y} y {p}_{z} .
- La tercera capa contiene un orbital 3s, tres orbitales 3p y cinco orbitales 3d, por lo que tiene una capacidad final de 18 electrones.
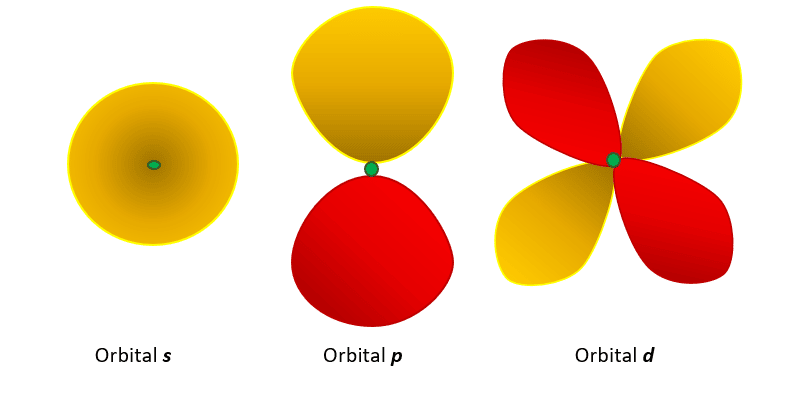
- Los orbitales s, tienen forma de esfera y el núcleo está centrado.
- Los orbitales p, tienen forma de mancuerna
- Cuatro orbitales d (de los 5 que existen) se asemejan a un trébol de 4 hojas.
- El 5to orbital d tiene un aspecto alargado de mancuerna con una esfera en torno a su centro.
Configuración electrónica del carbono
La disposición de electrones con mínima energía o configuración electrónica en estado basal del carbono es una lista de los orbitales que ocupan sus electrones, la cual es la siguiente:
1{s}^{2}2{s}^{2}2{p}^{2}
O también podemos encontrar la configuración electrónica del carbono como:
1{s}^{2}2{s}^{2}2{p}_{x}^{1}2{p}_{y}^{1}
Electrones de valencia del C: 4 (aquellos que se encuentran en la capa más externa).

Configuración electrónica del carbono en estado basal de energía.
Los electrones se comportan como si estuvieran girando en torno a un eje (espín) por ello se representan con dos flechas \uparrow \downarrow de orientaciones opuestas, es decir, espín opuesto.
Si se encuentran libres dos o más orbitales con energías iguales, los electrones se distribuyen de forma paralela en cada uno para dejarlos medio llenos, como ocurre en la segunda capa de energía del carbono en el orbital p. Esto se conoce como la regla de Hund.
Hibridación del átomo de carbono
Cuando se origina un enlace covalente los electrones se comparten y se produce una superposición de átomos mediante sus orbitales. Cuando se establecen enlaces con varios elementos existe un reordenamiento espacial de los mismos y se denomina hibridación.
- Orbitales híbridos \mathit{s}{\mathit{p}}^{3} : Se forma cuando un orbital s se hibrida con tres orbitales p adoptando una geometría tetraédrica. Los enlaces son mucho más fuertes y estables que los orbitales no hibridados s y p. Supone la combinación de los cuatro orbitales atómicos de la capa de valencia del carbono. El ángulo de enlace es de 109.5°. Ejemplo, la estructura del metano (compuestos de enlaces sencillos).
- Orbitales híbridos \mathit{s}{\mathit{p}}^{2} : Se origina por la combinación del orbital 2s con dos orbitales p (de los tres disponibles) y un orbital 2p queda intacto. Forman ángulos de enlaces de 120° en el plano. Ejemplo, estructura del eteno (compuestos de dobles enlaces).
- Orbitales híbridos sp: Se da cuando el orbital 2s se combina solamente con un orbital p. Su ángulo de enlace es de 180°. Explica la formación de triples enlaces como la estructura del acetileno.
El superíndice indica cuántos orbitales de cada tipo se combinan para formar un híbrido y no se relaciona con el lugar ocupado por los electrones. Esta técnica te ayudará a memorizar cuántos orbitales de cada uno están combinados, por ejemplo:
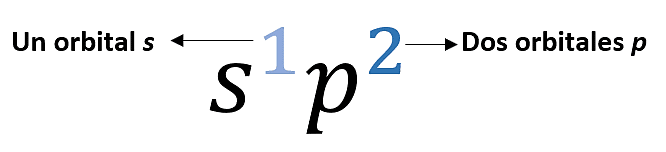
¿Por qué el carbono es tetravalente?
Como estudiante, a menudo surgen interrogantes similares. Pero, la teoría y las cualidades del carbono nos ayudan a contestar.
Los electrones de valencia son aquellos que se encuentran en la capa más externa del átomo. El carbono tiene 4 electrones en su último nivel de energía, lo cual explica su tetravalencia y la capacidad que tiene para formar millones de compuestos a través de la formación de múltiples enlaces.
¿A qué grupo pertenece el átomo de carbono?
En él se observa una transición de elementos con propiedades no metálicas a metálicas a medida que aumenta el número atómico siguiendo una dirección de arriba hacia abajo. Por lo tanto:
- El carbono es un no metal, se encuentra al inicio del grupo y en el segundo período.
- Le sigue el silicio y el germanio, los cuales son metaloides.
- Y, por último, el estaño y el plomo que son metales.
De todos ellos, el carbono y el silicio son los elementos más abundantes en la naturaleza. El C es un componente esencial de la materia viva y el silicio de la corteza terrestre.
Tipos de carbono
Los átomos de carbono que se encuentran formando cadenas carbonadas se clasifican de acuerdo al número de átomos de carbono adicionales unidos a él.
- Carbono primario: N° de átomos de carbono unidos a él 1. Siempre son terminales.
- Carbono secundario: N° de átomos de carbono unidos a él 2. Siempre se localizan en el intermedio de la cadena.
- Carbono terciario: N° de átomos de carbono unidos a él 3. Siempre son intermedios.
Ejemplo:
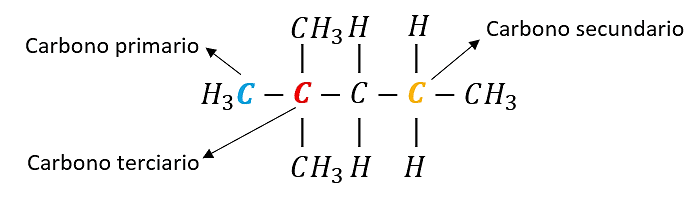
¿Dónde se encuentra el carbono?
El carbono se encuentra formando todo tipo de materia viva. Pero, no sólo se relaciona con los seres vivos, también lo podemos encontrar en una variedad de compuestos industriales, combustibles, disolventes, aceites esenciales y más.
A continuación, una lista de las diversas sustancias que se encuentran conformadas por carbono y que están involucradas en el estudio de la química orgánica:
- Gas natural: Es una mezcla de hidrocarburos (compuestos únicamente por C – H), tanto gaseosos como vapores que se encuentran en formaciones porosas de la corteza terrestre.
- Petróleo: Es un líquido inflamable, negro, espeso y aceitoso que se utiliza para la producción de combustible, principalmente. Está formado por una mezcla de hidrocarburos, por lo general alcanos de cadena recta. Aunque la composición del petróleo varía de un lugar a otro.
- Cloruro de etilo: Se emplea como anestésico y refrigerante.
- Cloroformo: Es un líquido incoloro de olor sofocante, poco soluble en agua que se utiliza como anestésico y como solvente.
- Insecticidas: El nexaclorobenceno y el para-diclorobenceno, ambos compuestos son utilizados en la industria agrícola como insecticidas.
- Glicerina: Es un líquido incoloro, viscoso que se disuelve en agua y en etanol. Se emplea para mantener húmedo el tabaco, como agente suavizador en el celofán, en preparaciones de cosméticos, ya que disuelve una gran cantidad de sustancias que pueden penetrar a través de la piel.
- Alcohol de madera: Es el metanol, su nombre común fue adoptado porque se obtiene de la destilación seca de la madera a 400°C. Es un compuesto tóxico y peligroso que provoca ceguera e incluso la muerte si es ingerido. Se utiliza como desnaturalizante en la fabricación de barnices y como combustible en los vehículos de carreras.
- Urea: Se utiliza en la preparación de ácido barbitúrico, alimentación del ganado, abono nitrogenado.
- Drogas sulfa: Son compuestos de gran importancia en la industria farmacéutica ya que tienen propiedades germicidas para el cuidado y desinfección de heridas.
- Biomoléculas: El carbono tiene parte fundamental en la estructura de los carbohidratos, lípidos y proteínas.

