Determinar el nombre de los compuestos orgánicos, muchas veces no es tarea sencilla. Pero en este post te traemos el paso a paso de la nomenclatura de alcanos.

También encontrarás las propiedades físicas y químicas de los alcanos, lo que te ayudará a diferenciarlos de los diversos compuestos que conforman la química orgánica.
Propiedades generales de los alcanos
Los alcanos son la familia de moléculas orgánicas más sencillas. También se conocen con el nombre de hidrocarburos saturados o parafinas. La denominación de “saturados” se debe a que poseen la máxima cantidad de hidrógenos que una cadena carbonada puede permitir.
Conoce más acerca de las propiedades generales de los alcanos en el post alcanos, alquinos y alquenos en donde también se encuentra la fórmula general que utiliza cada grupo funcional mencionado.
Propiedades físicas de los alcanos
Estado físico de los alcanos
A una temperatura constante de 25 °C se puede definir que:
- Los hidrocarburos que poseen desde un carbono hasta cuatro carbonos son gaseosos.
- Desde cinco carbonos hasta 17 carbonos son líquidos.
- Las cadenas carbonadas de 18 carbonos en adelante son sólidas, como por ejemplo la grasa animal, la cual posee largas cadenas C – H saturadas.
Punto de ebullición de los alcanos
El punto de ebullición incrementa a medida que aumenta el número de átomos de carbono presentes en la cadena.
Lo que quiere decir que el punto de ebullición del nonano (151 °C) es superior al del propano ( – 42 °C).
Sin embargo, es importante reconocer que las ramificaciones que posea el alcano aminoran marcadamente el punto de ebullición del compuesto.
Por ejemplo:
El pentano: C{H}_{3}-C{H}_{2}-C{H}_{2}-C{H}_{2}-C{H}_{3} tiene un punto de ebullición ubicado en los 36.1 °C
Mientras que, el isopentano, tiene un punto de ebullición inferior de 28°C, lo que evidencia la disminución del valor del punto de ebullición a medida que el compuesto posee ramificaciones.
\begin{array}{ccc}\begin{array}{cc}C{H}_{3}& -\end{array}& \begin{array}{cc}\begin{array}{c}\\ CH\\ \begin{array}{c}|\\ C{H}_{3}\end{array}\end{array}& -\end{array}& \begin{array}{cc}C{H}_{2}& \begin{array}{cc}-& C{H}_{3}\end{array}\end{array}\end{array}
Isopentano
Punto de fusión de los alcanos
A diferencia del incremento del punto de ebullición con el aumento de C presentes en la cadena carbonada.El punto de fusión de los alcanos aumenta con el número de átomos de carbono y simetría de la molécula en estudio.
Es decir, que se observa una variación a medida que se avanza de un alcano con un número par de átomos de carbono, al siguiente con un número impar de átomos de carbono.
Por ejemplo: el punto de fusión del propano es – 187 °C, y del butano es – 138 °C la diferencia es de 51 °C entre el butano y el propano. Pero, el butano se funde a una menor temperatura que el metano (punto de fusión – 183 °C) y el etano (punto de fusión – 172 °C).
Densidad de alcanos
Densidad de algunos alcanos a 20 °C:
| Alcano | Densidad (g/mL) a 20 °C |
|---|---|
| Pentano | 0.626 |
| Hexano | 0.659 |
| Heptano | 0.684 |
| Octano | 0.703 |
Como lo expresa la teoría, la densidad de los alcanos es inferior a la densidad del agua a 4 °C.
Solubilidad de alcanos
Los alcanos son compuestos no polares o de polaridad muy baja, por lo tanto, son incapaces de formar puentes de hidrógeno lo que trae como resultado incapacidad para disolverse en agua.
En cambio, los alcanos en estado líquido son miscibles entre sí y por lo general se disuelven en solventes débilmente polares como el cloroformo, benceno, tetracloruro de carbono, entre otros.
Propiedades químicas de los alcanos
A temperatura ambiente, los alcanos no reaccionan con la mayoría de los reactivos comunes:
- Ácidos y bases fuertes
- Oxidantes fuertes como el permanganato de potasio
- Reductores fuertes
Las reacciones más importantes de los alcanos son:
Combustión de alcanos
Cuando se somete un alcano al calor generado por una llama, estos reaccionarán con el oxígeno atmosférico para producir dióxido de carbono (gaseoso) y agua (líquido).
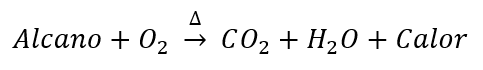
Halogenación de alcanos
Rección de sustitución por radicales libres. Cuando un alcano se encuentra en presencia de luz ultravioleta o es calentado por encima de los 300 °C reaccionarán con halógenos como el Cl o el Br para producir mezclas de derivados halogenados y desprendiendo halogenuros de hidrógeno. Por ejemplo:
Cloración del metano:
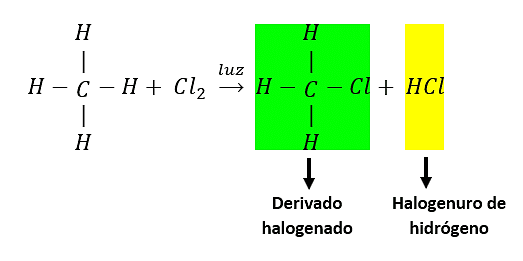
Se debe tener presente que la mezcla de los derivados halogenados indica que todos los átomos de hidrógeno del alcano pueden ser sustituidos por halógenos (son susceptibles de sustitución) como lo indica la imagen:
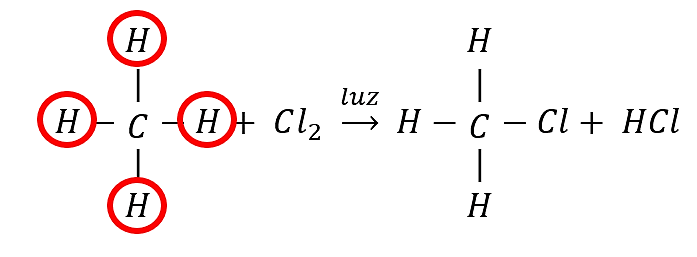
Cada hidrógeno del alcano puede ser sustituido por un halógeno, en este caso cloro. La luz UV provee la energía para que se desarrolle la reacción.
Pirólisis o Cracking
Descomponer una sustancia por la mera acción del calor se denomina pirólisis. La pirólisis de alcanos, en particular al petróleo, se conoce como cracking.
Es un procedimiento que consiste en hacer pasar los alcanos de alto peso molecular por una cámara a temperaturas elevadas, entre 400 °C y 600 °C, para convertirlos en alcanos más livianos, alquenos (como eteno) e hidrógeno.
La ecuación que representa la pirólisis es:
Alcano \stackrel{400-600 °C}{\to } Alcanos livianos+alquenos+{H}_{2}
Nomenclatura de alcanos según la IUPAC
Antes de estudiar la nomenclatura de alcanos hablemos de los radicales alquilo, los cuales son importantes para nombrar las ramificaciones de los hidrocarburos.
Son radicales que se obtienen al eliminar un átomo de hidrógeno de un alcano. Se representan por -R y se nombran cambiando la terminación -ano por -il o-ilo .
| Alcano | Radical alquilo | ||
|---|---|---|---|
| Nombre | Fórmula | Nombre | Fórmula |
| Metano | CH_{4} | Metil o metilo | -CH_{3} |
| Etano | C_{2}H_{6} | Etil o etilo | CH_{3}-CH_{2}- |
| Propano | C_{3}H_{8} | Propil o propilo | CH_{3}-CH_{2}-CH_{2}- |
| Butano | C_{4}H_{10} | Butil o butilo | CH_{3}-CH_{2}-CH_{2}-CH_{2}- |
Otros radicales alquílicos de importancia son:
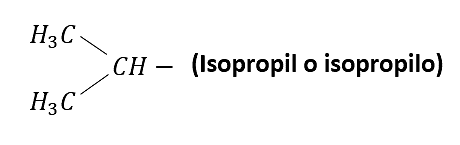
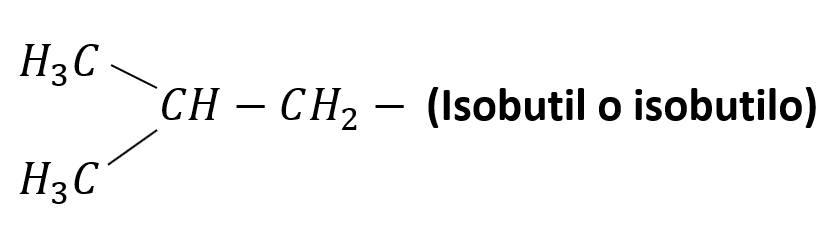
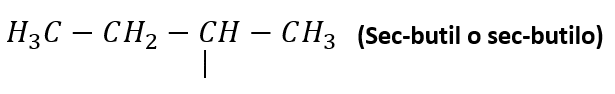
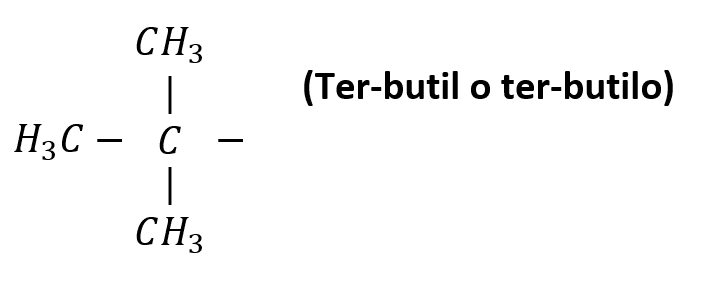
Nomenclatura de alcanos lineales
El sufijo -ano es el representante de este grupo funcional.
Los primeros 4 integrantes de los alcanos se identifican por los siguientes nombres:
| Nombre | Fórmula condensada | Fórmula semi desarrollada |
|---|---|---|
| Metano | CH_{4} | - |
| Etano | C_{2}H_{6} | H_{3}C-CH_{3} |
| Propano | C_{3}H_{8} | CH_{3}-CH_{2}-CH_{3} |
| Butano | C_{4}H_{10} | H_{3}C-CH_{2}-CH_{2}-CH_{3} |
Observa que la diferencia entre cada uno de ellos es un -C{H}_{2} y así sucederá con los alcanos de cadenas carbonadas más extensas.
Los alcanos que siguen luego del butano se nombran señalando el número de átomos de carbono presentes utilizando los prefijos griegos -penta, -hexa, -hepta y así sucesivamente sin la “a” final, ya que se sustituye por el sufijo -ano que identifica al grupo funcional.
| Nombre | Fórmula condensada | Fórmula semi desarrollada |
|---|---|---|
| Pentano | C_{5}H_{12} | CH_{3}-(CH_{2})_{3}-CH_{3} |
| Hexano | C_{6}H_{14} | CH_{3}-(CH_{2})_{4}-CH_{3} |
| Heptano | C_{7}H_{16} | CH_{3}-(CH_{2})_{5}-CH_{3} |
| Octano | C_{8}H_{18} | CH_{3}-(CH_{2})_{6}-CH_{3} |
| Nonano | C_{9}H_{20} | CH_{3}-(CH_{2})_{7}-CH_{3} |
| Decano | C_{10}H_{22} | CH_{3}-(CH_{2})_{8}-CH_{3} |
| Undecano | C_{11}H_{24} | CH_{3}-(CH_{2})_{9}-CH_{3} |
Lo importante es conocer el número de carbonos del compuesto, elegir la numeración griega correspondiente y colocar el sufijo -ano.
Por ejemplo: Si te piden que escribas la fórmula semidesarrollada de un hexano, ya el nombre te dice que posee 6 C y el sufijo -ano indica que es un alcano, por lo tanto, la fórmula semidesarrollada será:
\begin{array}{c}C{H}_{3}-C{H}_{2}-C{H}_{2}-C{H}_{2}-C{H}_{2}-C{H}_{3}\\ o\\ C{H}_{3}-{\left(C{H}_{2}\right)}_{4}-C{H}_{3}\end{array}
El subíndice 4 junto al ( C{H}_{2} ) indica que la cadena posee 4 C{H}_{2}
Nomenclatura de alcanos ramificados
Si el hidrocarburo saturado posee ramificaciones se deben seguir los siguientes pasos:
- Encontrar la cadena carbonada principal, es decir, la cadena continúa de átomos de carbono más larga (cadena base).
- Se comienza la numeración desde el carbono más próximo al punto de ramificación.
- Cuando hay más de dos radicales se nombran por orden alfabético, sí hay radicales repetidos se utilizan los prefijos di-, tri-, tetra-, y se coloca delante de ellos el número del carbono en el cual se ubican.
- Los números se separan por comas, y los números de las letras se separan por guiones.
- Por último, se escribe el nombre del hidrocarburo base en una sola palabra, seguido del sufijo -ano .
Es importante destacar que, por propósitos de redacción, cuando se escribe el nombre de un alcano, el prefijo sin guion “iso-” se considera parte del radical correspondiente, es decir, se considera parte del nombre isobutilo, y en el listado alfabético se ordena por la “i”.
Pero, los prefijos “sec-“ y “ter-“ no forman parte del nombre del radical, por lo tanto, cuando se van a ordenar alfabéticamente en la nomenclatura de un compuesto, se consideran por la “b” el sec-butilo y el ter-butilo.
Aplicamos los pasos aprendidos nombrando según la IUPAC el siguiente alcano:
Ejemplo 1: Nombrar el siguiente alcano
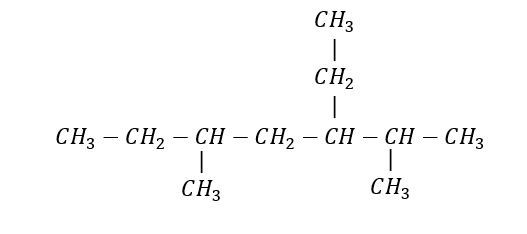
Identificamos la cadena base en el compuesto:
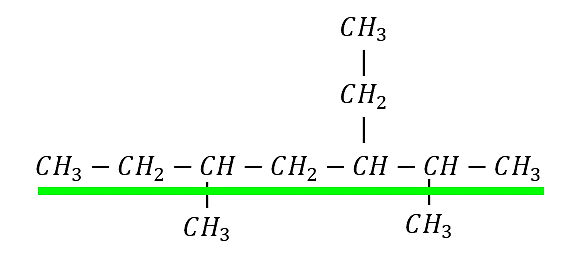
Cadena base de 7 carbonos: heptano
La numeración de los carbonos se inicia del extremo derecho hacia el izquierdo
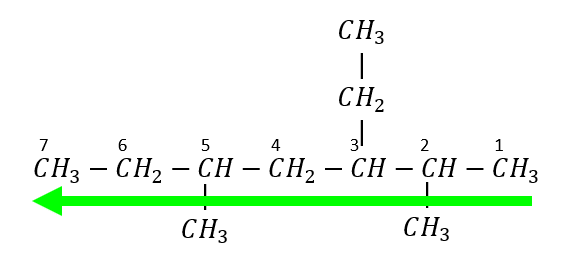
Se identifican los radicales presentes y la ubicación dentro de la cadena carbonada:
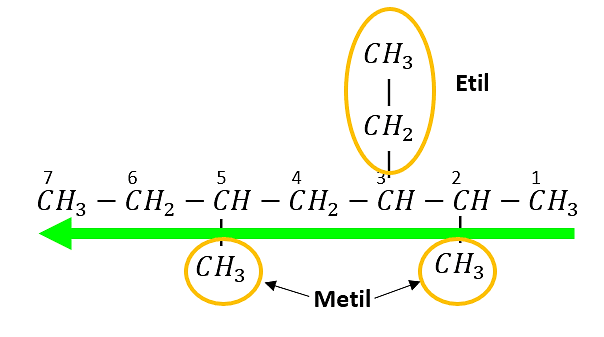
Un etil en el carbono 3
Un metil en el carbono 2 y uno en el carbono 5
El nombre del alcano es:
3 – etil – 2,5 – dimetilheptano
- Se agregó el prefijo di- al radical metilo para señalar que hay dos de ellos presentes en la cadena carbonada.
- Para ordenar alfabéticamente se comienza con el radical etil seguido del metil; para el listado alfabético no se toma en cuenta el prefijo di-.
Ejemplo 2: Nombrar el siguiente compuesto según las normas de la IUPAC
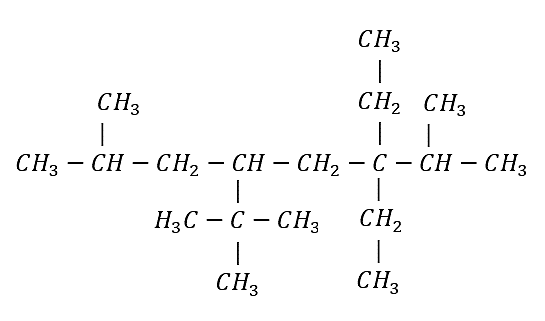
Identificamos la cadena base:
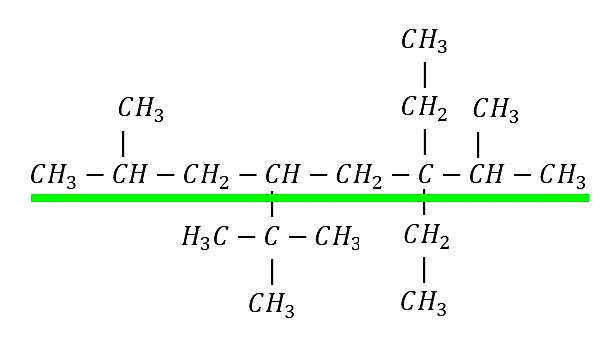
Cadena principal de 8 carbonos: octano
La numeración se inicia del extremo derecho al izquierdo. Aunque hay ramificaciones a la misma distancia de ambos extremos, se comienza a numerar en el extremo más cercano al segundo punto de ramificación.
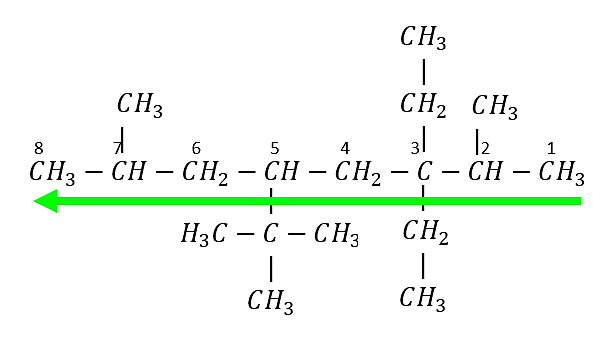
Se identifican los radicales presentes y la ubicación dentro de la cadena carbonada:
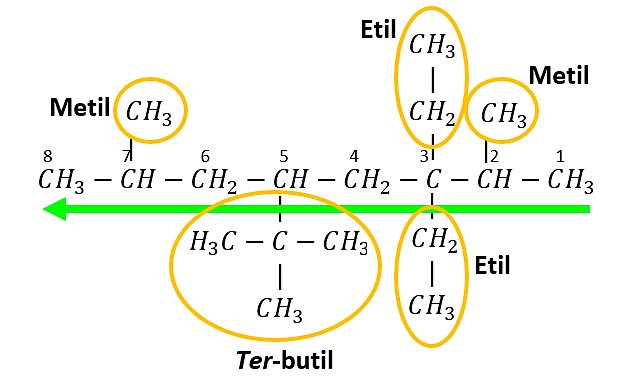
Un metil en el carbono 2 y uno en el carbono 7
Dos etilos en el carbono 3
Un ter-butil en el carbono 5
El nombre del alcano es:
5–ter-butil–3,3–dietil–2,7– dimetiloctano
También se puede nombrar según el orden de complejidad de los radicales alquilo (desde el menos complejo hasta el más complejo), en este sentido, el nombre del alcano sería:
2,7-dimetil-3,3-dietil-5-ter-butiloctano

